Titulación de Naoh con fenolftaleína hcl?
Dentro del matraz agregar 2-3 gotas del indicador de fenolftaleína y aproximadamente 20 mL de agua destilada. Girando el matraz, añadir gota a gota la solución de NaOH presente en la bureta a la solución de HCl presente en el matraz. ... Tenga en cuenta el volumen de NaOH consumido en la titulación.
¿Cómo calculo los moles de NaOH y HCl en una titulación?
NaOH + HCl NaCl + H2O- Cálculo de la molaridad de la solución de HCl:
- n° moli di NaOH en 18 mL = M x V (L) =
- = 0,1 mol / L x 0,018 L = 0,0018 mol de NaOH.
- Entonces, incluso en 15 ml de ácido estarán presentes.
- 0,0018 mol de HCl. 15 mL = 0,015 L. M(HCl) = = = 0,12 mol/ L.
- La solución de HCl es 0,12 M.
¿Cuál es el propósito de la titulación ácido-base?
La titulación ácido-base es un ensayo cuantitativo utilizado para determinar la concentración de una solución ácida o básica desconocida mediante la adición de volúmenes medidos de una solución titulante ácida o básica conocida que neutraliza el analito.
¿Cuál es el pH del cambio de color?
El intervalo de cambio de color indica el rango de variación de pH que se debe producir para que el ojo humano perciba el cambio de color de la forma ácida a la básica y viceversa.
¿Para qué sirve la fenolftaleína?
La fenolftaleína es un indicador de pH común utilizado en valoraciones ácido-base. Su fórmula química cruda es C20H14O4. A temperatura ambiente, la fenolftaleína se presenta en forma de polvo cristalino blanco inodoro, insoluble en agua y soluble en etanol (14 g/l).
Clases de laboratorio - Valoración ácido-base
Encuentra 19 preguntas relacionadas
¿Cuándo viste La fenolftaleina?
Es un ácido débil con una constante Ka igual a 4 · 10-10 y tiene la característica de ser incoloro a valores de pH ácidos y rosado a valores de pH básicos teniendo un rango de cambio de color entre 8.2 y 9.8.
¿Para qué sirve el indicador?
Los indicadores son herramientas capaces de mostrar (medir) la tendencia de un fenómeno que se considera representativo para el análisis y se utilizan para monitorear o evaluar el grado de éxito o la adecuación de las actividades implementadas.
¿Qué es un indicador ácido base?
Los "indicadores de pH" son compuestos químicos halocrómicos, es decir, presentan un cambio visual -generalmente de color- alrededor del punto de equivalencia entre el paso de una forma ácida a una forma básica, este paso se da para cada indicador a su propio valor de pH. .
¿Cuándo se alcanza el punto de cambio de color?
Cuando KIn = [H3O+], es decir pKIn = pH, tenemos: log [HIn] = log [In−], el indicador está en su punto de inflexión, es decir, asume un color intermedio entre A y B. . .. Los indicadores se utilizan en valoraciones de ácido y base.
¿Qué son los ácidos y las bases?
Según la teoría de Arrhenius, un ácido es una sustancia que al disociarse en agua libera iones H+. Por otro lado, una base es una sustancia que, al disociarse en agua, libera iones OH-.
¿Qué sucede en el matraz mientras se procede con la titulación ácido-base?
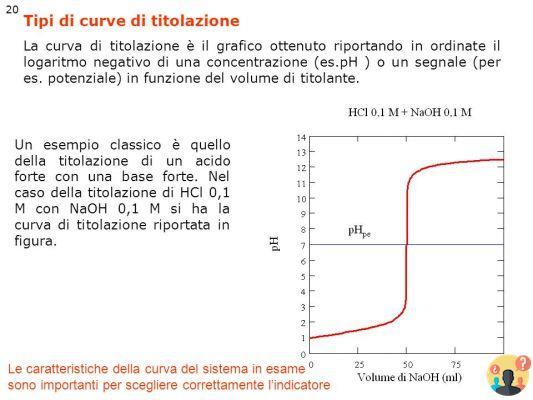
TITULACIÓN DE UN ÁCIDO o DE UNA BASE FUERTE Ejemplo: titula HCl con NaOH: Por cada gota que añadimos de la bureta al matraz, el TITOLAND es consumido por el TITOLANT y por tanto el pH de la solución en el matraz aumenta.
¿Cuál es el título de una solución?
El título de una solución no es otra cosa que su concentración; decir que una disolución de HCl tiene un título de 0,1 M significa que su concentración es de 0,1 moles/litro.
¿Para qué sirve el patrón primario?
patrón primario (sustancia madre): es un compuesto suficientemente puro a partir del cual se puede preparar la solución estándar pesando directamente una cierta cantidad y luego diluyéndola hasta un volumen definido de solución.
¿Cómo hacer los cálculos para las titulaciones?
Método. Se disuelve una cantidad conocida de la muestra a analizar en un disolvente adecuado. A esta solución se le añaden gradualmente cantidades de un segundo reactivo (llamado titulador), también en forma de solución con una concentración estrictamente conocida, hasta que se completa la reacción entre ambos.
¿Cómo se neutraliza el ácido clorhídrico?
El pH de la reacción en el punto de equivalencia depende de la naturaleza de los reactivos y por tanto de la sal que se forma. Un caso típico de neutralización está representado por la reacción estequiométrica entre el ácido clorhídrico y el hidróxido de sodio llevada a cabo en un solvente acuoso: HCl + NaOH → NaCl + H2O.
¿Qué principio químico es la base de las valoraciones ácido-base?
La base química de cada titulación es una reacción de neutralización, que ocurre cuando, en el mismo sistema, un ácido y una sustancia básica entran en contacto.
¿Cómo eliges el indicador?
En general, el indicador se elige de modo que su rango de tonos se encuentre dentro de la sección vertical de la curva de titulación, es decir, cuando se registra un cambio brusco en el pH.
¿Qué hace que los indicadores ácido base cambien de color?
- El cambio de color se produce en torno a un valor de pH que depende del indicador, y que corresponde al pH en el que las dos formas se encuentran en igual cantidad. - El intervalo de cambio de color es el cambio de pH requerido para observar el cambio de color; es generalmente dos unidades de pH.
¿Qué sucede en el punto de equivalencia?
El punto de equivalencia, o punto estequiométrico, de una reacción química es el punto en el que se mezclan cantidades equivalentes de un ácido y una base. ... El punto final (relacionado con el punto equivalente pero no coincidente) se refiere al punto donde el indicador cambia de color en una titulación colorimétrica.
¿Qué es el líquido indicador?
El indicador universal es una solución de color oscuro que contiene una mezcla de indicadores que se pueden agregar a una solución para determinar su pH. Un indicador es una sustancia que sufre variaciones de color según el entorno químico en el que se encuentre.
¿Qué son los indicadores de salud?
Los indicadores de salud son un conjunto de datos de vigilancia analizados con el fin de proporcionar una evaluación del estado de salud de la población, para establecer de manera adecuada las prioridades y acciones a tomar en pro de la salud pública.
¿Cuáles son los indicadores naturales?
Los indicadores son especies químicas que tienen la particularidad de variar su color según el medio en el que se encuentren: ácido, básico o neutro. ... Uno de estos indicadores naturales es utilizado todo el tiempo por todos nosotros: el té.
¿Cómo funcionan los indicadores metalocrómicos?
Durante la titulación, el titulador se une a los iones metálicos presentes en la solución hasta llegar al punto final donde compite con el indicador, llevando el indicador de su forma compleja a su forma libre con la consiguiente variación de color.
¿Para qué sirve el indicador universal?
Un indicador universal es un indicador cromático de pH, que consiste en una mezcla de varias sustancias que, cuando se colocan en un medio acuoso, varían su color en relación con el pH de la solución.
¿Cómo se usa el papel tornasol?
Cómo funciona la prueba de fuego
Después del contacto, este papel se vuelve rojo en caso de acidez, o azul en caso de basicidad. En particular, se vuelve rojo en un ambiente ácido con un pH inferior a 4,4 y se vuelve azul en un ambiente básico con un pH superior a 8,0.