¿Segunda energía de ionización?
La segunda energía de ionización es la necesaria para alejar un electrón de un ion gaseoso con carga positiva.
¿Por qué la segunda energía de ionización es mayor que la primera?
La primera ionización separa un electrón p, la segunda separa uno s del subnivel completo s. La energía de ionización del tercer electrón es mayor porque, a medida que el átomo pierde electrones, su carga nuclear permanece constante y los electrones restantes se mantienen más firmemente.
¿Cómo se calcula la segunda energía de ionización?
Una vez hecho esto, para calcular la energía de ionización, salvo que el átomo ya haya perdido algunos electrones, tendrás que sacar la raíz cuadrada de Z y multiplicar el resultado por 13,6. El resultado obtenido debe expresarse en electronvoltios.
¿Qué significa primera energía de ionización?
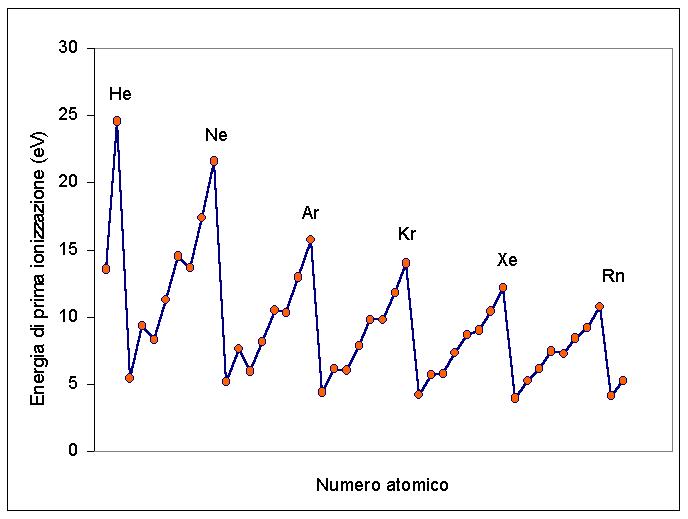
La energía de ionización de un átomo o de una molécula es la energía mínima requerida para arrancar un electrón y llevarlo a una distancia infinita, al cero absoluto, y en condiciones de energía cinética cero.
¿Cuántas energías de ionización hay?
En primer lugar, la energía de ionización se define como la energía, expresada en Kcal/mol (o KJ/mol), necesaria para que un mol de átomos en estado gaseoso se transforme en un mol de cationes monovalentes.
Energía de ionización - Lección 6 - ¡Química para exámenes de ingreso!
Encuentra 23 preguntas relacionadas
¿Cómo se ve el átomo cuando se le quita un electrón?
Para sacar un electrón de un átomo, y luego convertirlo en un ion, se puede suministrar cierta cantidad de energía, llamada energía de ionización, que varía según la especie atómica. ... Eventualmente, sin embargo, el átomo y su electrón perdido tenderán a recombinarse; cuando esto sucede, se emite un fotón.
¿Por qué la energía de ionización disminuye a lo largo de un grupo?
La disminución descendente a lo largo de un grupo se explica por el hecho de que al pasar de un período al siguiente el electrón más externo ocupa un nivel más alejado del núcleo y por lo tanto es menos retenido.
¿Qué es la energía de ionización y cómo varía en la tabla periódica?
La energía de ionización es la energía necesaria para eliminar el electrón más débilmente conectado de un átomo. ... A medida que avanza de derecha a izquierda en la tabla periódica, el radio atómico aumenta y la energía de ionización aumenta de izquierda a derecha en los períodos y hasta los grupos.
¿Qué es la electronegatividad y cómo varía en la tabla periódica?
La electronegatividad es una propiedad de todos los elementos de la tabla periódica a excepción de los gases nobles del octavo grupo y es la capacidad que tiene un átomo de atraer un electrón hacia sí. El valor 4 se le dio al elemento más electronegativo que es el flúor y valores cada vez más bajos a los demás elementos.
¿Qué es la energía de enlace?
En física y química, la energía de enlace es la energía necesaria para mantener unidas las partes de un sistema compuesto.
¿Cómo varía el radio atómico en la tabla periódica?
Tendencia en la tabla periódica
El radio atómico depende sobre todo de la carga efectiva del elemento: a medida que aumenta, el radio atómico disminuye. En la tabla periódica, por lo tanto, disminuye a lo largo del período y aumenta a lo largo del grupo.
¿Cómo se llama el ion positivo?
Los átomos que tienen una carga distinta de cero se llaman iones. Na+ es un ion positivo. Cl- es un ion negativo. Un átomo que se ioniza es por tanto un átomo que pierde o adquiere electrones.
¿Por qué la energía de ionización de los gases nobles es mayor que la de los elementos pertenecientes al mismo período?
La energía de ionización disminuye a medida que aumenta el radio atómico. Es la tendencia de un átomo a adquirir electrones cuando tiene el último nivel incompleto. ... Los gases nobles tienen energías de ionización muy altas y afinidad electrónica positiva: su tendencia es a no ceder y no comprar electrones.
¿Por qué aumenta la energía de ionización durante el período?
La primera energía de ionización tiene una tendencia periódica; en particular, aumenta durante un período y disminuye a medida que desciende en un grupo. ... Moviéndose hacia la derecha durante un período, la energía de ionización tiende a aumentar porque el electrón externo es atraído por más protones en el núcleo.
¿Qué átomo tiene el radio más grande?
Dado que el potasio está al comienzo del período 3 y el bromo al final del mismo período, el potasio tendrá un radio atómico más grande que el bromo y, por lo tanto, el radio atómico más grande de los cuatro átomos dados.
¿Cuáles son los dos parámetros que influyen en la energía de ionización?
Se utilizan dos parámetros para dar una idea de cuánto tiende un átomo a atraer o alejar electrones: la electronegatividad y la energía de ionización respectivamente.
¿Cuándo es un elemento más electronegativo?
La electronegatividad es la capacidad de un átomo para atraer hacia sí los electrones de enlace. Los elementos más electronegativos pertenecen al grupo VII subgrupo A (VIIA) y el flúor (F) es el elemento más electronegativo, su electronegatividad según Pauling es igual a 4.
¿Cuál es el elemento más electronegativo del NaCl?
Un ejemplo de enlace iónico lo da el cloruro de sodio (NaCl). El cloro tiene una electronegatividad mucho más alta que el sodio (3,0 frente a 0,9).
¿Cómo ves si un átomo es más electronegativo que otro?
Los átomos que se encuentran en la parte superior de la tabla periódica tienen una mayor electronegatividad. Por esta razón, los elementos ubicados en la esquina superior derecha tienen mayor electronegatividad que los de la esquina inferior izquierda.
¿Qué átomo tiene la mayor afinidad electrónica?
Los elementos con mayores valores de afinidad electrónica (es decir, los que tienen mayor tendencia a adquirir un electrón para dar iones negativos) son los del lado derecho de la tabla periódica y en particular los halógenos.
¿Qué átomo tiene la mayor tendencia a transformarse en un catión?
Cuanto menor sea el valor de la energía de ionización, mayor será la tendencia del átomo a liberar electrones y convertirse en un catión. Cuanto mayor sea el valor de la afinidad electrónica, mayor será la tendencia de un átomo a adquirir electrones y convertirse en anión.
¿Cómo varía la afinidad electrónica en un grupo?
La afinidad electrónica se puede asociar con el tamaño del átomo: cuanto mayor, menor es el volumen atómico. ... Por lo tanto: la afinidad electrónica aumenta de abajo hacia arriba en un grupo y de izquierda a derecha durante un período.
¿Cómo varían los radios atómicos de los halógenos a medida que descienden a lo largo del grupo?
Descendiendo en el grupo, a medida que aumenta el número atómico, disminuye el poder oxidante y la electronegatividad, mientras que aumentan los puntos de ebullición y fusión.
¿Cuándo se excitan los electrones?
El estado excitado es el estado de un átomo en el que uno de sus electrones se encuentra en un nivel de energía superior al que normalmente ocupa (estado fundamental). ... La energía liberada puede ser en forma de radiación electromagnética, calor u otras formas de energía.


























