¿Qué son las energías de ionización?
La energía de ionización de un átomo o de una molécula es la energía mínima requerida para arrancar un electrón y llevarlo a una distancia infinita, al cero absoluto, y en condiciones de energía cinética cero. Por tanto, la energía necesaria para que tenga lugar el siguiente proceso: X (g) → X + (g) + e− I.
¿Para qué se utiliza la energía de ionización?
La energía de ionización es la energía necesaria para eliminar el electrón más débilmente conectado de un átomo. ... Los elementos químicos a lo largo de la tabla periódica tienen una energía de ionización mucho más baja (debido a que los electrones están más lejos del átomo a medida que aumenta el radio atómico).
¿Cuál es la definición de energía de ionización, cuál es su tendencia en los grupos en los períodos?
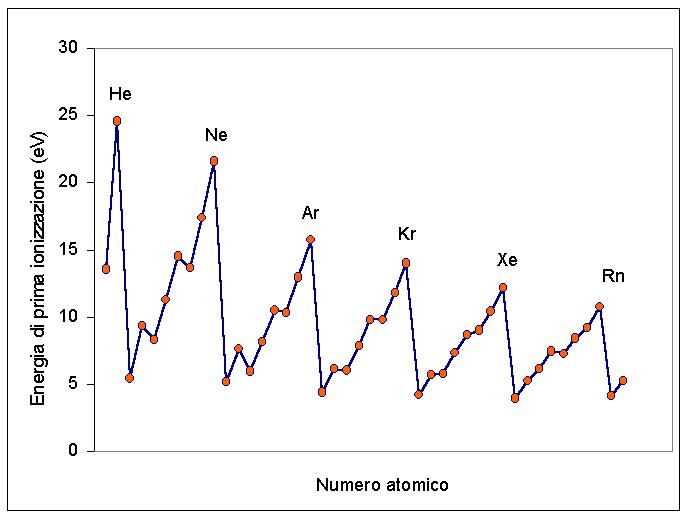
Evolución de la energía de ionización en la tabla periódica. La primera energía de ionización aumenta de abajo hacia arriba en grupos y de izquierda a derecha en periodos. ... De hecho, cuanto más lejos estén los electrones del núcleo, menos energía se necesitará para separarlos.
¿Cómo calcular la energía de ionización de un átomo?
Una vez hecho esto, para calcular la energía de ionización, salvo que el átomo ya haya perdido algunos electrones, tendrás que sacar la raíz cuadrada de Z y multiplicar el resultado por 13,6. El resultado obtenido debe expresarse en electronvoltios.
¿Cómo entender la energía de ionización?
Para alejar electrones de un átomo, es necesario proporcionar energía, llamada energía de ionización, que se mide en kilojulios por mol (kJ/mol), en kilocalorías por mol (kcal/mol) o en electronvoltios (eV). Si el primer electrón externo se aleja del átomo, la energía se denomina primera energía de ionización.
ENERGÍA DE IONIZACIÓN
Encuentra 19 preguntas relacionadas
¿Cómo varía la energía de ionización en la tabla periódica?
La primera energía de ionización es una propiedad periódica. Moviéndose a lo largo de un período de la tabla periódica de izquierda a derecha I1 aumenta, mientras que moviéndose hacia abajo en el mismo grupo disminuye. Hay mucha regularidad en esta tendencia en los bloques principales.
¿Qué es el potencial de ionización?
Cuando suministramos energía a un sistema somos capaces de arrancar electrones haciendo del átomo neutro un ion positivo. la energía necesaria para arrancar electrones se llama potencial de ionización.
¿Cómo calcular la energía de ionización del hidrógeno?
La fórmula que los define en un átomo de hidrógeno viene dada por la ecuación: E = -E0 / n2, donde E0 = 13.6 eV (1 eV = 1.602 × 10-19 Joule) y n = 1,2,3... Y así Calle.
¿Qué se entiende por afinidad electrónica y cuál es la tendencia en TP?
Por afinidad electrónica entendemos la cantidad de energía liberada o absorbida por un electrón cuando se le añade un átomo neutro aislado en la fase gaseosa para permitir la formación de un ion gaseoso con carga igual a menos uno.
¿Por qué la energía de ionización disminuye en el grupo Todos aumenta en Z?
La disminución descendente a lo largo de un grupo se explica por el hecho de que al pasar de un período al siguiente el electrón más externo ocupa un nivel más alejado del núcleo y por lo tanto es menos retenido. Se necesita menos energía para alejar un electrón de un átomo de cesio que de un átomo de sodio.
¿En qué estado físico debe encontrarse el elemento cuyos valores de energía de primera ionización por afinidad electrónica se miden?
La afinidad electrónica (Eea) es la energía liberada o gastada por un átomo o molécula cuando se le añade un electrón a su configuración, cuando se encuentra en estado neutro aislado en forma gaseosa, para formar un ion negativo.
¿Qué es la electronegatividad y cómo varía en la tabla periódica?
La electronegatividad es una propiedad de todos los elementos de la tabla periódica a excepción de los gases nobles del octavo grupo y es la capacidad que tiene un átomo de atraer un electrón hacia sí. El valor 4 se le dio al elemento más electronegativo que es el flúor y valores cada vez más bajos a los demás elementos.
¿Por qué aumenta la energía de ionización durante el período?
La primera energía de ionización tiene una tendencia periódica; en particular, aumenta durante un período y disminuye a medida que desciende en un grupo. ... Moviéndose hacia la derecha durante un período, la energía de ionización tiende a aumentar porque el electrón externo es atraído por más protones en el núcleo.
¿Qué significa el número de Avogadro?
, es el número de partículas (átomos, moléculas o iones) contenidas en un mol. Esta constante tiene las dimensiones de la inversa de una cantidad de sustancia (es decir, mol-1). Esta constante es igual a 6,02214076 × 1023.
¿Qué elementos tienen los valores más altos de afinidad electrónica?
Los elementos del séptimo grupo son los que tienen los valores más altos de afinidad electrónica y por lo tanto la mayor tendencia a adquirir un electrón.
¿Cuáles son los dos parámetros que influyen en la energía de ionización?
Se utilizan dos parámetros para dar una idea de cuánto tiende un átomo a atraer o alejar electrones: la electronegatividad y la energía de ionización respectivamente.
¿Qué átomo tiene la mayor afinidad electrónica?
Los elementos con mayores valores de afinidad electrónica (es decir, los que tienen mayor tendencia a adquirir un electrón para dar iones negativos) son los del lado derecho de la tabla periódica y en particular los halógenos.
¿Cómo se calcula la afinidad electrónica?
La afinidad electrónica, Eea, de un elemento es la energía liberada cuando un electrón se une al átomo en fase gaseosa: X (g) + e - (g) → X - (g).
¿Cómo se establece la electronegatividad?
Como puede verse, la electronegatividad aumenta en un grupo de abajo hacia arriba y en un período de izquierda a derecha: en consecuencia, los elementos más electronegativos se encuentran en la esquina superior derecha mientras que los menos electronegativos se encuentran en el lado opuesto, en el esquina inferior izquierda.
¿Cómo se encuentran los niveles de energía?
El término nivel de energía indica el conjunto de estados de energía correspondientes a un determinado valor de n (número cuántico principal). Entonces: n = 1 es el primer nivel de energía, n = 2 es el segundo nivel de energía, n = 3 es el tercer nivel de energía, etc.
¿Qué átomo tiene tendencia a formar iones positivos?
Explica por qué los metales tienden a formar iones positivos mientras que los no metales tienden a formar iones negativos. Los primeros tienen baja energía de ionización, los últimos tienen energías de afinidad electrónica más altas.
¿Por qué la energía de ionización de los gases nobles es mayor que la de los elementos pertenecientes al mismo período?
La energía de ionización disminuye a medida que aumenta el radio atómico. Es la tendencia de un átomo a adquirir electrones cuando tiene el último nivel incompleto. ... Los gases nobles tienen energías de ionización muy altas y afinidad electrónica positiva: su tendencia es a no ceder y no comprar electrones.
¿Qué son los electrones de valencia?
Qué son y cómo calculan el número de electrones de valencia. Los electrones de valencia de un átomo son los electrones presentes en su último nivel de energía; son los que participan en la formación de enlaces químicos y son los que determinan las propiedades químicas de un elemento.
¿Qué son los números cuánticos?
En mecánica cuántica un número cuántico expresa el valor de una cantidad conservada en la dinámica de un sistema. Los números cuánticos permiten cuantificar las propiedades de una partícula y describir la estructura electrónica de un átomo.
¿Cómo varía el volumen en la tabla periódica?
Las dimensiones atómicas (radios o volúmenes atómicos) aumentan a lo largo de los grupos y disminuyen a lo largo de los períodos. ... La afinidad electrónica, que es la energía que se libera cuando un átomo adquiere un electrón, aumenta de izquierda a derecha a lo largo del período y disminuye a lo largo del grupo a medida que aumenta el número atómico.