¿Qué significa reacciones exotérmicas y endotérmicas?
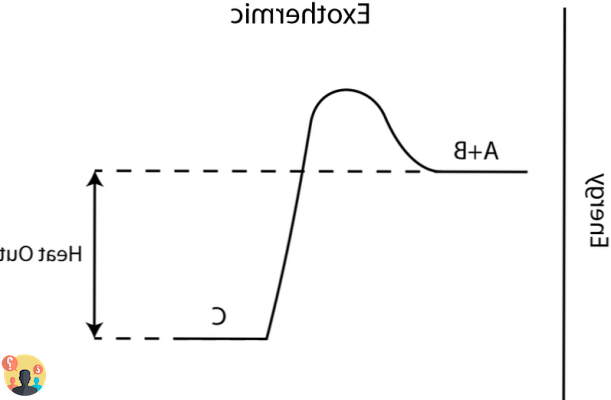
Reacciones endotérmicas y exotérmicas Una reacción química que desarrolla calor durante su desarrollo se denomina "exotérmica", mientras que una reacción química que durante su desarrollo absorbe calor del exterior se denomina "endotérmica".
¿Qué se entiende por reacción endotérmica?
- 1. Que se acompaña de absorción de calor: reacción química y .; compuesto p. ej., un compuesto más o menos inestable que se forma con la absorción de calor y que, al descomponerse, libera el calor absorbido durante la formación (por ejemplo, explosivos).
¿Cómo funcionan las reacciones exotérmicas y endotérmicas de Zanichelli?
Reacciones exotérmicas: la entalpía disminuye (ΔH <0) y el sistema cede calor al ambiente (Q = –ΔH). Reacciones endotérmicas: aumenta la entalpía (ΔH > 0) y el sistema absorbe calor del ambiente (Q = + ΔH). ... La entropía (S) es la cantidad física que mide el desorden de un sistema.
¿Qué reacciones son endotérmicas?
Una reacción endotérmica es la de la fotosíntesis, en la que reaccionan el dióxido de carbono y el agua, formando glucosa y oxígeno; la reacción ocurre solo con una entrada de energía luminosa.
¿Para qué reacción se requiere la mayor cantidad de energía?
La energía absorbida es mayor que la suministrada y los productos de una reacción endotérmica tienen una energía superior a la de los reactivos, es decir, Hp> Hre, por tanto ΔH = Hp> Hr> 0.
Reacciones exotérmicas y endotérmicas.
Encuentra 26 preguntas relacionadas
¿Cómo ves si la reacción es exotérmica o endotérmica?
Reacciones endotérmicas y exotérmicas
Una reacción química que desarrolla calor durante su desarrollo se denomina "exotérmica", mientras que una reacción química que durante su desarrollo absorbe calor del exterior se denomina "endotérmica".
¿Qué indica el criterio de máximo desorden?
Dado que la condición de máxima probabilidad coincide con la de máximo desorden, se sigue que: todo sistema evoluciona espontáneamente hacia el estado de máximo desorden. La entropía (S) es la cantidad termodinámica que expresa el estado de desorden de un sistema dado.
¿Qué son los coches endotérmicos?
El automovilismo es un término asociado al concepto de pasión. Empecemos aprendiendo esto: el motor de combustión interna es una máquina que convierte la energía térmica contenida en un combustible en energía cinética, mediante un proceso de combustión interna. ...
¿Cómo se expresa una reacción endotérmica y espontánea?
Cabe señalar que una reacción exotérmica desorganizadora será espontánea a cualquier temperatura (independientemente del tiempo que tarde en producirse), mientras que una reacción endotérmica y de ordenación nunca se producirá, bajo ninguna condición: si se quiere obtener ese producto se tendrá que partir de otros reactivos.
¿Qué es el proceso exotérmico?
En termodinámica, un proceso exotérmico se define como una transformación que implica una transferencia de calor del sistema al medio ambiente. Si además el proceso es isobárico, esto también corresponde a una disminución de la entalpía del sistema.
¿Cuál es la relación entre la reacción espontánea y el estado de desorden?
La segunda ley de la termodinámica establece que todo proceso espontáneo va acompañado de un aumento global de la entropía y que los sistemas físicos evolucionan espontáneamente hacia el estado de mayor entropía. Desde el punto de vista entrópico, una reacción química es espontánea cuando ocurre con un aumento de entropía.
¿Qué indican δu y δh?
El calor se mide por el aumento de temperatura ΔT de un baño (a la capacidad térmica C, conocida por la calibración): ΔH = nCp ΔT. El calor se mide por el aumento de temperatura ΔT de un baño (a la capacidad térmica C, conocida a partir de la calibración): ΔU = nCv ΔT.
¿Por qué siempre ocurren intercambios de calor durante una reacción química?
En las reacciones químicas siempre hay un intercambio entre estas dos formas de energía (térmica y química): la ruptura de los enlaces de las moléculas de los reactivos libera los átomos que forman estas moléculas y estos átomos se conectan entre sí de forma diferente, formando nuevos moléculas (los productos de la reacción) con nuevos enlaces...
¿Qué se entiende por reacción química?
Una reacción química es un proceso o transformación de la materia que conduce a la formación de nuevas sustancias, productos, transformando profundamente las sustancias de partida, los reactivos. Una reacción química es un proceso en el que se forman y/o rompen enlaces entre átomos de un mismo elemento o de elementos diferentes.
¿Cuántos productos se obtienen de una reacción de descomposición?
Clasificación y explicación de las reacciones de descomposición. Las reacciones de descomposición son aquellas reacciones en las que se forman dos o más productos a partir de un solo reactivo.
¿Cuáles son los metales que no se combinan con el oxígeno?
Solo el oro, la plata y el platino (metales nobles) no reaccionan con el oxígeno puro. Es una reacción de síntesis en la que un metal y un no metal se combinan, a altas temperaturas, para formar una sal binaria.
¿Qué significa proceso espontáneo?
Un proceso espontáneo es una reacción química en la que el sistema libera energía libre (a menudo en forma de calor) y cambia a un estado de energía más bajo y termodinámicamente más estable.
¿Cómo reconocer una reacción espontánea?
Predecir la espontaneidad de una reacción química.
Más específicamente, en condiciones estándar: si ∆G0 <0, la reacción procede espontánea e irreversiblemente hasta el equilibrio; si ∆G0 = 0 la transformación está en equilibrio (no procede); si ∆G0 > 0 no se produce la transformación.
¿Qué es Delta G?
El cambio de energía libre de Gibbs, ΔG, calculado en una reacción química a P y T constantes, nos dice cuánta energía está realmente disponible para trabajar a esa presión y temperatura. ΔG <0: el proceso es espontáneo. El valor de ΔG indica el trabajo “útil” que se puede obtener.
¿Por qué se llama motor de combustión interna?
El significado estricto de endotérmico podría explicarse por 'combustión interna', definición que se refiere directamente a su principio de funcionamiento.
¿Qué pasará con los motores térmicos?
La prohibición de los vehículos de combustión interna será gradual durante cinco años y estará vinculada a los niveles de emisión. Según el plan presentado por el gobierno en 2017, se prohibirá la venta de turismos y vehículos comerciales ligeros con emisiones de CO2 superiores a 100 g/km a partir de 2025.
¿Qué pasará con los coches de gasolina?
La propuesta de la Comisión Europea prevé el cese total de las matriculaciones de nuevos modelos de gasolina o diésel. Todo para reducir las emisiones en un 2030% para 55 El objetivo es actuar en varios frentes, regulatorios e industriales, para reducir los gases nocivos en un 55% para 2030.
¿Por qué la entropía siempre aumenta?
La entropía se puede definir simplemente como la medida del grado de equilibrio alcanzado por un sistema en un momento dado. Con cada transformación del sistema que provoca una transferencia de energía (obviamente sin añadir otra energía del exterior), la entropía aumenta, porque el equilibrio no puede sino aumentar.
¿Qué dicen la primera y segunda leyes de la termodinámica?
La primera establece que en un proceso termodinámico el calor no se puede convertir completamente en energía; la segunda es que el calor no fluye espontáneamente de un cuerpo más frío a uno más caliente.
¿Qué dice la segunda ley de la termodinámica?
“Es imposible llevar a cabo una transformación cuyo único resultado sea el de transferir calor de un cuerpo más frío a uno más caliente sin la contribución de un trabajo externo” (formulación de Clausius).


























