¿Qué resultado obtienes al sumar las fracciones molares porcentuales?
De la misma definición de fracción molar se deduce que la suma de las fracciones molares de todos los componentes de una solución es igual a 1.
¿Cuál de las siguientes soluciones es la más concentrada?
En términos generales, se dice que una solución está concentrada si una gran cantidad de soluto está presente en cierto volumen de solvente; en la situación opuesta la solución se diluye. Indica los gramos de soluto contenidos en 100 g de solución.
¿Cómo calcular fracciones molares usando porcentaje de masa?
Porcentaje de masa (soluto) = 100% x [masa (soluto) / (masa (solución)). Abreviamos masa (solución) con "m" por simplicidad y obtenemos: masa (soluto) = mx [porcentaje de masa (soluto) / 100%], y masa (disolvente) = m-masa (soluto).
¿Qué se entiende por relación molar?
Definición de relación molar
Una relación molar es la relación de las cantidades en moles de dos compuestos cualesquiera que intervienen en una reacción química. Las relaciones molares se utilizan como factores de conversión entre productos y reactivos en muchos problemas químicos.
¿Qué significa la fracción molar en una razón?
La fracción molar (X) de una solución es la relación entre el número de moles de un soluto y el número de moles totales. ... De la definición misma de fracción molar se deduce que la suma de las fracciones molares de todos los componentes de una solución es igual a 1.
Píldoras químicas: la fracción molar
Encuentra 38 preguntas relacionadas
¿Cuáles son las proporciones de peso?
Cuando dos o más elementos se combinan para dar un compuesto, lo hacen de acuerdo con una relación de peso determinada y constante. ... Por lo tanto, la relación en peso de los elementos en un compuesto debe ser siempre la misma.
¿Cómo cambiar de porcentaje en peso a porcentaje en volumen?
Para encontrar el porcentaje de masa/volumen en su lugar, divida los gramos de soluto por 10:% m/v = 98/10 = 9,8%. Por lo general, se puede aplicar la siguiente fórmula: % m / v = (M * PM) / 10.
¿Cuál es el porcentaje en masa de una solución?
La concentración porcentual masa/masa (%m/m) de una solución o incorrectamente peso/peso (%p/p), corresponde a los gramos de soluto disueltos en 100 gramos de solución. El %m/m es un ejemplo de cálculo de porcentaje.
¿Cómo se calcula el porcentaje en peso?
Para ello primero debemos determinar la masa del soluto (por ejemplo 25g), luego calcular la masa de la solución sumando la masa del solvente (100 + 25) a la del soluto y finalmente determinar el porcentaje en peso por dividiendo la masa del soluto por la de la solución y multiplicando el resultado por 100 (...
¿Qué solución de NaOH está más concentrada?
¿Qué solución de NaOH está más concentrada? ¡¡Hola!! Para responder hay que transformar todas las distintas soluciones en concentración molar (M) y compararlas: la de mayor molaridad es la más concentrada.
¿Cómo se calcula el porcentaje de concentración en masa?
El porcentaje de masa es uno de los métodos utilizados para expresar la concentración de una solución. Viene dado por la relación porcentual entre la masa del soluto y la masa de la solución.
¿Cómo se calcula el pH de una solución?
El pH es un índice de la concentración de los iones H+ en una solución (más precisamente, el logaritmo decimal negativo de la concentración molar de los iones H+ en la solución: pH = - log [H+]).
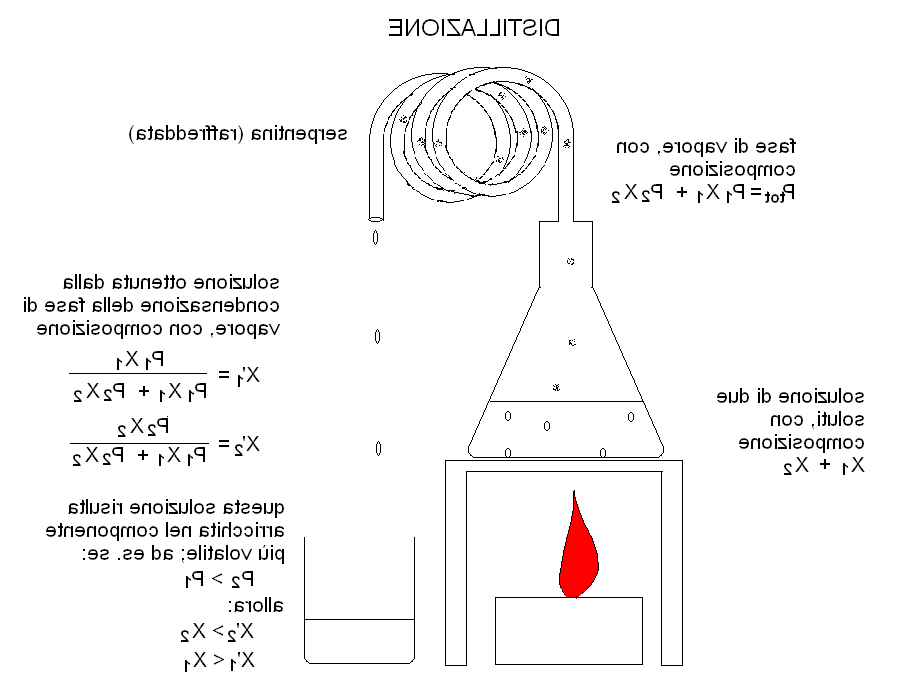
¿Qué dice la ley de Raoult?
El fenómeno descrito se rige por la ley de Raoult: la presión de vapor de una solución es directamente proporcional a la fracción molar del disolvente. donde: psolución = presión de vapor de la solución; ... Xsolvente = fracción molar del solvente.
¿Cuál es el solvente y cuál es el soluto?
En una disolución, la sustancia que prevalece en cantidad es el disolvente, mientras que las demás sustancias presentes en menor cantidad son los solutos. Por ejemplo, en el caso anterior de agua y azúcar, el agua es el solvente y el azúcar es el soluto. La composición de las soluciones es variable.
¿Qué significa el número de Avogadro?
, es el número de partículas (átomos, moléculas o iones) contenidas en un mol. Esta constante tiene las dimensiones de la inversa de una cantidad de sustancia (es decir, mol-1). ... El número de Avogadro, que tiene el mismo valor numérico que la constante de Avogadro, es en cambio una cantidad adimensional: 6,02214076 × 1023.
¿Cómo obtengo los gramos del porcentaje?
Convertir porcentajes a gramos
Divide el porcentaje por 100, o de manera equivalente, mueve el lugar decimal dos puntos a la izquierda para hacerlo. Esto significa que el 25 por ciento es 0,25, el 44 por ciento es 0,44 y el 10 por ciento es 0,1. Usando este mismo método, el 8 por ciento es 0,08.
¿Cómo calculas la masa?
Para encontrar la masa de un objeto, multiplica su densidad por el volumen. Durante esta operación, presta mucha atención a las unidades de medida involucradas para obtener la correcta con la que expresar la masa (kilogramos o gramos).
¿Cómo se calcula masa a masa?
Para calcular la masa conociendo la densidad y el volumen, necesitamos multiplicar la densidad por el volumen.
¿Cómo pasar de peso a volumen?
Para calcular el volumen de los materiales, conociendo el peso y el peso específico relativo, se procede a dividir el peso por el peso específico. Para calcular el peso de los materiales, conociendo el peso específico y el volumen relativo, se procede a multiplicar el peso específico por el volumen.
¿Cómo diluir al 2 por ciento?
Para la desinfección de biberones, tetinas, etc., se suele recomendar una dilución que obtenga una solución al 2%. Se obtiene diluyendo 20 ml del producto concentrado en un litro de agua potable (incluida el agua del grifo).
¿Cómo se pasa del porcentaje de peso a la molaridad?
De concentración porcentual a molaridad- d = m/V msoluz. = d×V = 1,18 g/mL×10 mL = 11,8 g.
- mHNO3 = msoluz. ×C%/100 = 11,8 g × 30/100 = 3,54 g.
- n HNO3 = m/mmolar = 3,54 g/63,01 g/mol = 0,0562 mol.
- M = n/V(L) V(L) = n/M = 0,0562 mol/0,2 mol/L = 0,281 L = 281 mL.
¿Cuáles son las 3 leyes de ponderación?
Las leyes ponderales de la química.
- la ley de conservación de la masa, ley de Lavoisier; - La ley de las proporciones definidas, Ley de Proust; - La ley de las proporciones múltiples, ley de Dalton; - La ley de los equivalentes químicos, ley de Richter.
¿Qué sucede en una reacción química?
Una reacción química es un proceso o transformación de la materia que conduce a la formación de nuevas sustancias, productos, transformando profundamente las sustancias de partida, los reactivos. Una reacción química es un proceso en el que se forman y/o rompen enlaces entre átomos de un mismo elemento o de elementos diferentes.
¿Por qué son importantes las leyes de ponderación?
Las leyes del peso se refieren al peso de las sustancias. Fue AL Lavoisier, eminente químico francés, a quien se puede considerar el "padre" de la química, el primero en utilizar la balanza como método de investigación; en 1766 escribió: "la balanza es un medio de prueba fiel que no engaña a los químicos".


























