¿Qué es una reacción exotérmica?
Traducido del ingles-
¿Qué se entiende por reacción exotérmica?
Una reacción química que desarrolla calor durante su desarrollo se denomina "exotérmica", mientras que una reacción química que durante su desarrollo absorbe calor del exterior se denomina "endotérmica". Por lo tanto, una reacción exotérmica es una reacción que implica una transferencia de calor del sistema al medio ambiente.
¿Cómo saber si una reacción es exotérmica?
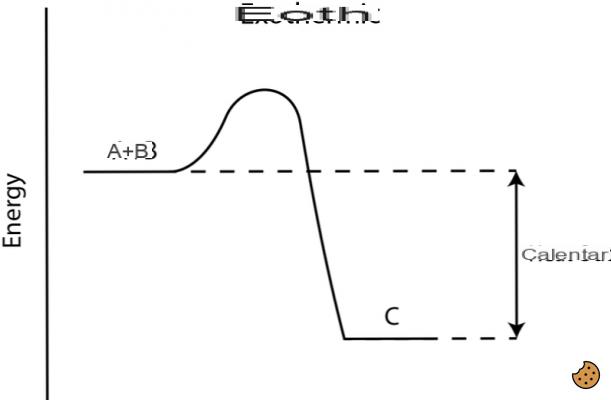
Las reacciones exotérmicas son aquellas reacciones en las que el sistema libera calor al medio ambiente. En estos casos es recomendable atribuir un signo algebraico negativo (-) al calor, por lo que ∆H también asume un signo negativo (∆H <0, es decir, H2 <H1): H disminuye.
¿Cómo saber si una reacción es exotérmica o endotérmica?
Reacciones exotérmicas y endotérmicas.
El calor involucrado en una reacción química se caracteriza por la entalpía de la reacción ΔH. Si ΔH > 0 la reacción es endotérmica, es decir, ocurre con absorción de calor, mientras que si ΔH <0 la reacción es exotérmica, es decir, ocurre con desarrollo de calor.
¿Cuándo un proceso es endotérmico?
En termodinámica, un proceso endotérmico se define como una transformación que implica un aumento de la entalpía del sistema y por tanto una transferencia de calor del medio ambiente al propio sistema. Adoptando el criterio egoísta, que toma como referencia el sistema, la variación de entalpía ΔH toma un valor positivo.
REACCIÓN ENDOTÉRMICA
Encuentra 37 preguntas relacionadas
¿En qué se diferencia un cambio de estado endotérmico de uno exotérmico?
Un proceso físico es endotérmico si el sistema absorbe el calor a expensas del medio ambiente, mientras que si el proceso es exotérmico, el sistema libera energía que se obtiene del medio ambiente. Ejemplos de procesos físicos son los cambios de estado a los que se relaciona un cambio de entalpía.
¿Para qué reacción se requiere la mayor cantidad de energía?
La energía absorbida es mayor que la suministrada y los productos de una reacción endotérmica tienen una energía superior a la de los reactivos, es decir, Hp> Hre, por tanto ΔH = Hp> Hr> 0.
¿Cuál es el factor más importante para determinar si una reacción es exotérmica o endotérmica?
¿Cuál es el factor más importante para determinar si una reacción es exotérmica o endotérmica? Para determinar si una reacción es exotérmica o endotérmica, primero es necesario medir el calor transferido o absorbido por el sistema.
¿Cómo afecta la temperatura al equilibrio químico?
un aumento en la temperatura hace que el equilibrio se desplace hacia la izquierda. Como consecuencia habrá una disminución en el valor del Keq. Una disminución de la temperatura, por el contrario, desplaza los dos equilibrios en dirección opuesta a la que se obtiene aportando calor.
¿Dónde tienen lugar las reacciones exotérmicas?
Las reacciones exotérmicas son aquellas que se dan con la producción de calor, es decir, transfieren energía del sistema al ambiente, mientras que las reacciones endotérmicas son aquellas que absorben calor del ambiente. Las reacciones exotérmicas provocan un calentamiento significativo tanto del sistema como del entorno.
¿Cómo varía la entalpía en una reacción exotérmica y endotérmica?
En las reacciones exotérmicas, la energía se suministra en forma de calor; la energía de los productos Hp es por tanto menor que la de los reactivos Hre por lo que la variación de energía, más conocida como variación de entalpía ΔH es menor que cero ya que ΔH = Hp - Hr.
¿Cuándo es una reacción endoergónica?
La endergónica es una reacción química que se produce con un aumento de la energía libre. ... En las reacciones endoergónicas, el contenido de energía libre de los productos es mayor que el contenido de energía libre de los reactivos.
¿Qué tipo de reacción es la combustión?
combustión Reacción de oxidación rápida de una sustancia, llamada combustible, por un agente oxidante, el comburente, acompañada de un alto desarrollo de calor ya menudo de luz. En la mayor parte del c. el comburente está constituido por el oxígeno del aire, pero en algunos casos puede ser diferente, por ej.
¿Cuáles son las reacciones químicas que liberan energía?
Cualquier reacción que libera energía se llama exotérmica. La respiración celular, que transforma un azúcar en agua y dióxido de carbono, también puede considerarse una reacción exotérmica. En otros casos, las reacciones absorben energía y, por lo tanto, se denominan endotérmicas.
¿Cuáles son los tipos de reacciones químicas?
Según el mecanismo por el cual se transforman los reactivos, las reacciones químicas se pueden dividir en:- reacciones de descomposición;
- reacciones de síntesis;
- Reacciones de intercambio simple;
- Reacciones de doble intercambio.
¿Cuáles son los productos y cuáles los reactivos?
Un reactivo se define como cualquier sustancia que participa en una reacción química consumiéndose a sí misma. A medida que avanza la reacción, los reactivos (generalmente indicados en el lado izquierdo de una ecuación química) se transforman en "productos de reacción" (generalmente indicados en el lado derecho de la ecuación química).
¿Cómo varía K a medida que cambia la temperatura?
En las reacciones endotérmicas, a medida que aumenta la temperatura, el equilibrio se desplaza hacia la derecha y aumenta el Keq. Por el contrario, al bajar la temperatura, el equilibrio se desplaza hacia la izquierda y el Keq disminuye. En las reacciones exotérmicas, a medida que aumenta la temperatura, el equilibrio se desplaza hacia la izquierda y el Keq disminuye.
¿Qué sucede si la temperatura de la solución aumenta durante una reacción química?
En una reacción exotérmica en equilibrio químico, el aumento de la temperatura desplaza este equilibrio hacia los reactivos, por lo que la reacción inversa se ve favorecida sobre la reacción directa para altas temperaturas.
¿Cuándo es espontánea una reacción química?
Un proceso espontáneo es una reacción química en la que el sistema libera energía libre (a menudo en forma de calor) y cambia a un estado de energía más bajo y termodinámicamente más estable.
¿Cómo puedo saber si se está produciendo una reacción?
Una forma sencilla de reconocer las reacciones redox es observar si hay variación en el número de oxidación de dos elementos diferentes. De hecho, si hay una variación en el número de oxidación, la reacción es redox.
¿Qué reacción es más rápida?
Una reacción ocurre más rápido si disolvemos los reactivos en agua y por el contrario, si queremos que no ocurra una reacción debemos evitar el contacto con el agua.
¿Cuál debe ser el signo de δs para que disminuya la energía libre?
c) cuando ΔH y ΔS tienen el mismo signo, la temperatura se vuelve decisiva para la espontaneidad o no del proceso: si TΔS ›ΔH entonces ΔG <0 y el proceso es espontáneo; si ΔH y ΔS son negativos, la temperatura debe ser lo suficientemente baja para que su diferencia tenga un valor negativo.
¿Qué indica el criterio de máximo desorden?
Dado que la condición de máxima probabilidad coincide con la de máximo desorden, se sigue que: todo sistema evoluciona espontáneamente hacia el estado de máximo desorden. La entropía (S) es la cantidad termodinámica que expresa el estado de desorden de un sistema dado.
¿Qué significa que una reacción es reversible?
El concepto de reacción reversible, en la terminología moderna, se aplica a una reacción química en la que los reactivos y los productos coexisten en equilibrio químico. Más precisamente, todas las reacciones químicas son termodinámicamente irreversibles. ...
¿Cómo saber si una reacción es espontánea?
Predecir la espontaneidad de una reacción química.
Más específicamente, en condiciones estándar: si ∆G0 <0, la reacción procede espontánea e irreversiblemente hasta el equilibrio; si ∆G0 = 0 la transformación está en equilibrio (no procede); si ∆G0 > 0 no se produce la transformación.


























