¿Qué es el titulador?
Se disuelve una cantidad conocida de la muestra a analizar en un disolvente adecuado. A esta solución se le añaden gradualmente cantidades de un segundo reactivo (llamado titulador), también en forma de solución con una concentración estrictamente conocida, hasta que se completa la reacción entre ambos.
¿Qué se entiende por valorante?
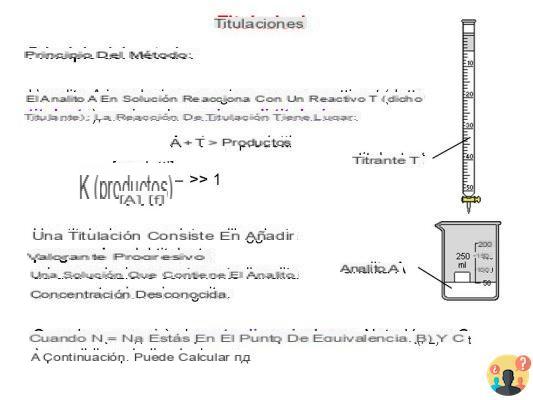
La titulación es una técnica de análisis químico utilizada para determinar la concentración desconocida de un ácido o base en una solución (analito) haciéndolo reaccionar con una solución de concentración conocida (título) de una base o ácido (titulante), respectivamente.
¿Cómo entender cuál es el indicador más adecuado?
La elección del indicador debe hacerse de forma que el cambio de color se produzca exactamente al pH correspondiente al punto equivalente. Esto no siempre es posible: se elige un indicador que tenga un pKIn lo más cercano posible al pH de la solución en el punto equivalente.
¿Para qué sirve la titulación?
La titulación ácido-base es un ensayo cuantitativo utilizado para determinar la concentración de una solución ácida o básica desconocida mediante la adición de volúmenes medidos de una solución titulante ácida o básica conocida que neutraliza el analito.
¿Cómo se hace una titulación en el laboratorio?
Elimine las burbujas de aire presentes en la parte inferior del grifo de la bureta abriendo rápidamente el grifo durante aproximadamente 1-2 segundos. Fije la bureta al soporte de la bureta. Lleve el menisco a cero en la escala graduada golpeando o rellenando el líquido dentro de la bureta.
Valoración
Encuentra 24 preguntas relacionadas
¿Qué sucede en el matraz mientras se procede con la titulación ácido-base?
Lentamente y agitando, se deja caer en el matraz la solución del otro reactivo (la base si hubiésemos introducido el ácido en el matraz, el ácido si hubiésemos introducido la base en el matraz) hasta que el indicador cambie de color (cambio de color del 'indicador); en este punto, si el indicador ha sido elegido correctamente, ...
¿Cómo se lleva a cabo la titulación ácido-base?
La titulación ácido-base es un tipo de titulación útil para determinar la concentración desconocida de un ácido (alcalimetría) o base (acidimetría), por medio de una reacción de neutralización que conduce a la formación de una sal más agua. La solución a valorar puede ser un ácido o una base, tanto débil como fuerte.
¿Qué es una titulación en química?
titulación En química, el proceso por el cual la cantidad de una sustancia A presente en la solución se determina agregando una solución titulada (es decir, a una concentración conocida) de un reactivo B hasta que se completa la reacción (punto de equivalencia).
¿Cuál es el título de una solución?
El título de una solución no es otra cosa que su concentración; decir que una disolución de HCl tiene un título de 0,1 M significa que su concentración es de 0,1 moles/litro.
¿Qué se entiende por punto de cambio de color?
El intervalo de cambio de color indica el rango de variación de pH que se debe producir para que el ojo humano perciba el cambio de color de la forma ácida a la básica y viceversa.
¿Cómo funciona el indicador ácido base?
Los "indicadores de pH" son compuestos químicos halocrómicos, es decir, presentan un cambio visual -generalmente de color- alrededor del punto de equivalencia entre el paso de una forma ácida a una forma básica, este paso se da para cada indicador a su propio valor de pH. .
¿Cómo se calcula el pH del punto equivalente?
El pH en el punto equivalente- Inicio: 0,006 HA 0,004 BOH 0 A–
- Equilibrio: 0,002 HA 0 0,004.
- nCH3COOH = M × V = 0,15 mol / L × 0,040 L = 6,0 × 10-3 mol = nNaOHAdd = nCH3COONcuya forma
- V NaOHAdd = nNaOHAdd / M = 6,0 × 10-3 mol / 0,1 mol / L = 0,060 L = 60 mL.
- Kb = Kw / (Ka = 10-14 / 1,8 × 10-5 = 5,6 × 10-10
¿Qué significa un indicador?
Los indicadores son herramientas capaces de mostrar (medir) la tendencia de un fenómeno que se considera representativo para el análisis y se utilizan para monitorear o evaluar el grado de éxito o la adecuación de las actividades implementadas.
¿Cuándo se alcanza el punto de equivalencia?
El punto de equivalencia o punto estequiométrico es el punto en una reacción química cuando hay exactamente suficiente ácido y base para neutralizar la solución. En una titulación, es donde los moles de valorante son iguales a los moles de solución de concentración desconocida.
¿Cómo hacer los cálculos para las titulaciones?
Se define como la relación del número de moles de la especie en solución por volumen en litros de solución: M = n/V [mol * l^-1]. Esta es la fórmula correcta para usar siempre que estemos en el proceso de tener que resolver este problema.
¿Para qué sirve el patrón primario?
patrón primario (sustancia madre): es un compuesto suficientemente puro a partir del cual se puede preparar la solución estándar pesando directamente una cierta cantidad y luego diluyéndola hasta un volumen definido de solución.
¿Qué se entiende por titulación?
En química, un proceso, también llamado análisis volumétrico o volumétrico, mediante el cual se determina la cantidad de una sustancia presente en un volumen dado de solución mediante la adición gradual de la solución titulada (es decir, con un título conocido) de otra sustancia capaz de reaccionar cuantitativamente. con eso; los ...
¿Qué es la titulación de fármacos?
En farmacología, la t. de un fármaco es el ajuste gradual de la dosis de un fármaco hasta lograr el efecto terapéutico deseado.
¿Para qué sirve la curva potenciométrica?
Se utiliza para valoraciones ácido-base, utilizando un medidor de pH, y valoraciones redox, de precipitación y complexométricas. Durante la titulación potenciométrica se obtiene una curva sigmoidea, de la cual es necesario obtener el punto de inflexión o “punto de equivalencia”.
¿Por qué se agita una solución?
La solución aparece completamente incolora. ... Este último se agita para favorecer una correcta mezcla; cuando el indicador se vuelve rosa, el flujo se detiene, detectando la cantidad de solución utilizada.
¿Cuáles son las herramientas y los reactivos necesarios para realizar una titulación?
La titulación manual clásica implica el uso de una bureta graduada de vidrio cargada con el titulador y un grifo para la adición gota a gota del reactivo hasta apreciar un cambio de color (tono) que indica el final de la reacción.
¿Cómo calculo los moles de NaOH y HCl en una titulación?
NaOH + HCl NaCl + H2O- Cálculo de la molaridad de la solución de HCl:
- n° moli di NaOH en 18 mL = M x V (L) =
- = 0,1 mol / L x 0,018 L = 0,0018 mol de NaOH.
- Entonces, incluso en 15 ml de ácido estarán presentes.
- 0,0018 mol de HCl. 15 mL = 0,015 L. M(HCl) = = = 0,12 mol/ L.
- La solución de HCl es 0,12 M.
¿Cómo se calcula el pH?
Defina el pH usando una ecuación.
La ecuación del pH es la siguiente: pH = -log [H3O +]. A veces, la ecuación del pH se puede representar de la siguiente manera: pH = -log [H +].
¿Cómo se neutraliza el ácido clorhídrico?
El pH de la reacción en el punto de equivalencia depende de la naturaleza de los reactivos y por tanto de la sal que se forma. Un caso típico de neutralización está representado por la reacción estequiométrica entre el ácido clorhídrico y el hidróxido de sodio llevada a cabo en un solvente acuoso: HCl + NaOH → NaCl + H2O.
¿Cómo calcular la concentración de una solución desconocida?
- Como d = m/V (g/mL) podemos transformar de esta manera.
- definir la concentración en los otros n/V=M.
- masa = nmol x MM.
- %masa = nsoluto MM en 100 g.
- dx V(1mL) = masa en 1mL (%masa/100) xdx V = gsoluto en 1mL.
- (%masa/100) xdx V/MM = nsoluto en 1 mL.
- (%masa/100) xdx 1000/MM = M (Molaridad, nmoli/Litro)