¿Qué es el calor latente de fusión?
En termodinámica, el calor latente es la cantidad de energía intercambiada durante una transición de fase. Por ejemplo, el "calor latente de fusión" es la energía máxima correspondiente a la transición de un sistema de un estado sólido a un estado líquido.
¿Cuál es la definición de calor latente de fusión?
Por ejemplo, el "calor latente de fusión" es la energía máxima correspondiente al paso de un sistema (compuesto por una o más sustancias químicas) del estado sólido al líquido.
¿Cuál es el calor latente del agua?
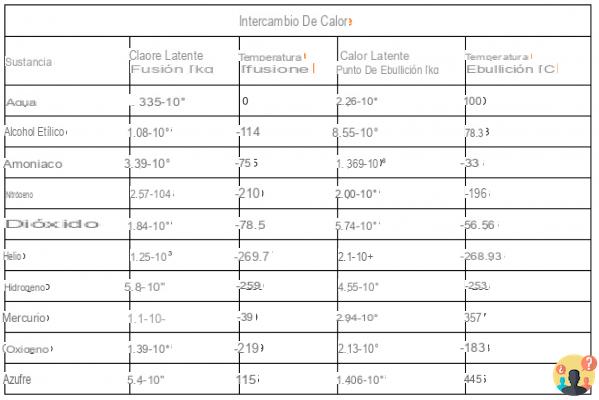
¿Cuál es el valor del calor latente de fusión del agua y el calor latente del agua hirviendo? En el Sistema Internacional, el calor latente se mide en cambio en J/kg; en este caso el calor latente de fusión del agua corresponde a 3,335 · 105 J/kg.
¿Cómo se define el calor latente de vaporización del agua?
El calor latente de evaporación del agua (también llamado ebullición) es de 2,272 × 106 julios por kilogramo y es la cantidad de calor que, a una presión de 1 atm, debe transferirse a 1 kilogramo de agua para la transición del estado líquido al se produce al gaseoso o, viceversa, se produce el paso del estado...
¿Por qué se llama calor latente?
Se llama latente porque el intercambio de calor no se revela por ninguna variación de temperatura. Ocurre en condiciones isotérmicas. El calor latente es igual a la diferencia de energía cinética de las partículas de un cuerpo entre el estado físico inicial y final.
CAMBIOS DE ESTADO, calor latente, fusión y solidificación, cambios de estado
Encuentra 17 preguntas relacionadas
¿Cómo varía el calor latente con la presión?
El calor latente también depende del cambio de fase que se considere y, para una misma sustancia y a la misma temperatura y presión, asume valores numéricos opuestos para cada cambio de estado y para su inverso (dependiendo de si la sustancia absorbe o libera calor).
¿Qué forma de energía modifica el calor latente?
El calor latente es la energía absorbida o liberada por una especie durante un cambio de estado sin cambio de temperatura. El calor latente puede entenderse como energía térmica que se suministra o se extrae para cambiar el estado de una sustancia sin cambiar su temperatura.
¿Cómo calcular el calor de vaporización?
La relación entre el calor q y la entalpía viene dada por la siguiente ecuación:- q = ΔHvap (mol) ...
- 1) Se lleva a ebullición una masa igual a 49.5 g de agua. ...
- 2) Calcular la entalpía de vaporización del agua en J/g y en cal/g.
¿Cómo se calcula el calor latente de condensación?
Calor latente de condensación
Es una propiedad intensiva de la materia y característica de toda sustancia pura. El calor latente de condensación es numéricamente igual pero de signo opuesto al calor latente de vaporización. El calor latente de condensación del vapor de agua corresponde a -2260 j/g = -540 cal/g.
¿Cómo calcular el calor latente de solidificación?
El calor latente de solidificación es numéricamente igual al calor latente de fusión. Se requieren 1 0 J para derretir 334 kg de hielo a 000°C; si 1 kg de agua a 0°C se solidifica y se convierte en hielo, proporciona 334 000 J de calor.
¿Cómo calcular el calor latente de fusión?
El valor del calor molar de fusión se puede determinar experimentalmente y se puede utilizar para resolver ejercicios explotando la relación:- q = ∆Hfus (masa / peso molecular) ...
- 1) Calcular la energía necesaria para derretir 0 gramos de agua a 31.5°C.
¿Cómo calcular el calor con calor latente?
Luego necesitamos calcular el calor necesario para derretir el hielo. El calor latente de fusión del hielo es Lf = 3.34 · 105 J. El calor necesario para producir una fusión completa del bloque de hielo viene dado por: Q2 = Lf · m = 3.34 · 105 · 0.3 J = 105 J.
¿Cuál es el calor específico del hielo?
(37.83 g) (El calor específico del hielo es igual a cg = 2051J/(kg K), el calor específico del agua es igual a aproximadamente = 4186,8 J/(kg K) y el calor latente de fusión del hielo es igual a Qlat_fusione = 3,3 ▪ 105 J / (kg K).
¿Por qué el calor latente de vaporización es mayor que el de fusión?
El calor latente de vaporización del agua es de 2260 kJ/kg (o 540 kcal); es unas siete veces mayor que la de la fusión. Esto significa que se necesita siete veces más energía para vaporizar cierta cantidad de agua que para derretir la misma cantidad de hielo (Figura 3).
¿Cómo se calcula el calor?
Q = c * metro * ∆T
donde: Q es el calor absorbido o cedido por el cuerpo. m es su masa. ∆T es la variación de temperatura.
¿Qué se entiende por calor sensible?
El calor sensible es el calor que provoca un cambio de temperatura en un objeto: cuando se calienta un objeto, su temperatura aumenta a medida que se le ha agregado calor. El aumento de calor se llama calor sensible.
¿A qué temperatura comienza la condensación?
A 0°C, el aire está saturado cuando el nivel de humedad es igual a 3,77g/kg de aire seco. Estas dos figuras ilustran el posible alcance de la condensación. El punto de rocío indica la temperatura a la cual el aire está saturado con vapor de agua. Es en este punto que comienza a formarse la condensación.
¿Cuándo comienza la condensación?
Bajo las condiciones adecuadas de temperatura y presión, la condensación ocurre si hay una superficie en la que el vapor de agua puede condensarse. Por ejemplo, cuando se forma rocío o escarcha, el suelo, las briznas de hierba u otros objetos en contacto con el suelo actúan como superficies de condensación.
¿Cuándo se produce la condensación?
La condensación ocurre cuando el aire tibio y húmedo entra en contacto con una superficie fría, como la del vidrio. El aluminio, por ejemplo, tiende a conducir el frío al interior del ambiente, generando el contraste frío/calor que favorece la condensación.
¿Qué son los cambios de estado?
la transición del estado sólido al líquido → fusión. transición de estado líquido a gaseoso → vaporización. transición de estado gaseoso a líquido → condensación. la transición del estado sólido al gaseoso → sublimación.
¿Cuál es la unidad de medida de la capacidad térmica?
En el Sistema Internacional la unidad de medida de la capacidad térmica es el J/K. Es decir, expresa la cantidad de calor en joules (J) y la temperatura en kelvins (K).
¿Cuándo la entropía tiene un valor negativo?
El cambio de entropía puede ser positivo o negativo. En particular, es positivo cuando el sistema recibe calor y negativo cuando lo libera.
¿Cómo cambia la entropía de un sistema durante la transición de líquido a sólido?
Cuando hay un cambio de estado de la fase líquida a la sólida, se pasa de un estado de mayor desorden a un estado de menor desorden y por lo tanto la entropía disminuye. En este caso, dado que el cambio de estado es exotérmico, tanto la variación de entalpía como la variación de entropía asumen un valor negativo.
¿Cómo cambia la entropía del agua cuando se enfría?
Enfriar el agua líquida disminuye aún más el desorden porque las moléculas se vuelven cada vez más lentas hasta que, a una temperatura de cero grados centígrados, el líquido se solidifica y se convierte en hielo.
¿Cuál es el papel del calor durante los cambios de estado?
Cuando se calienta un sólido, la agitación de sus moléculas aumenta y los enlaces que las mantienen unidas se separan. ... Cuando se enfría un aeriforme, la agitación de las moléculas disminuye hasta que se pueden volver a establecer enlaces entre ellas: el aeriforme se vuelve líquido.