¿Qué es el calor latente?
En termodinámica, el calor latente es la cantidad de energía intercambiada durante una transición de fase. Por ejemplo, el "calor latente de fusión" es la energía máxima correspondiente a la transición de un sistema de un estado sólido a un estado líquido.
¿Qué se entiende por calor latente?
En termodinámica, el calor latente (indicado con el símbolo λ, la letra griega lambda) es la cantidad de energía intercambiada (en forma de calor) durante el curso de una transición de fase (o "cambio de estado").
¿Qué significa el calor latente de ebullición?
El calor latente de ebullición (λe) es la cantidad de energía necesaria para evaporar completamente 1 gramo de sustancia a la temperatura de ebullición (100 °C a una presión de 1 atmósfera).
¿Por qué hablamos de calor latente durante los cambios de estado?
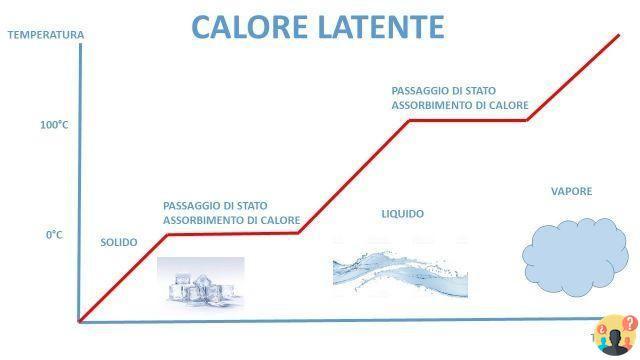
Latente significa "que no se ve" (del latín latere, permanecer oculto) porque, como se mencionó anteriormente, la absorción de calor no se manifiesta con un aumento de temperatura. Curva de calentamiento del agua destilada: se observa que durante la fusión y la ebullición la temperatura se mantiene constante.
¿Qué forma de energía modifica el calor latente?
El calor latente es la energía absorbida o liberada por una especie durante un cambio de estado sin cambio de temperatura. El calor latente puede entenderse como energía térmica que se suministra o se extrae para cambiar el estado de una sustancia sin cambiar su temperatura.
EL CALOR LATENTE
Encuentra 32 preguntas relacionadas
¿Cómo varía el calor latente con la presión?
El calor latente también depende del cambio de fase que se considere y, para una misma sustancia y a la misma temperatura y presión, asume valores numéricos opuestos para cada cambio de estado y para su inverso (dependiendo de si la sustancia absorbe o libera calor).
¿Cómo calcular el calor latente de solidificación?
El calor latente de solidificación es numéricamente igual al calor latente de fusión. Se requieren 1 0 J para derretir 334 kg de hielo a 000°C; si 1 kg de agua a 0°C se solidifica y se convierte en hielo, proporciona 334 000 J de calor.
¿Qué sucede con la temperatura durante el cambio de estado?
Sin embargo, la característica clave es que, a pesar del intercambio de calor, la temperatura corporal permanece constante durante todo el proceso. ... Entonces es posible recoger todo el vapor producido y calentarlo para llevarlo a temperaturas más altas, pero durante el cambio de estado la temperatura permanece constante.
¿Qué sucede con la temperatura durante los cambios de estado?
Cuando un cuerpo se calienta, la energía de las partículas aumenta hasta vencer a las fuerzas cohesivas, provocando la transición de estado; al contrario, al enfriarlo, las partículas disminuyen su movimiento y se sienten más las fuerzas de cohesión.
¿Cuánto vale el calor latente del agua?
Para agua a una temperatura de 100 °C, el calor latente es de 539 Kcal/kg (2257 kJ/kg): para evaporar un kg de agua a 100 °C, se requiere aproximadamente 5,39 veces más calor para calentar la misma cantidad de agua de 0°C a 100°C.
¿Cómo calcular el calor de vaporización?
La relación entre el calor q y la entalpía viene dada por la siguiente ecuación:- q = ΔHvap (mol) ...
- 1) Se lleva a ebullición una masa igual a 49.5 g de agua. ...
- 2) Calcular la entalpía de vaporización del agua en J/g y en cal/g.
¿Qué es el calor y cómo se mide?
El calor en Física es una cantidad definida como una forma de energía, y en particular como energía intercambiada entre dos sistemas entre los cuales hay una diferencia de temperatura. El equivalente mecánico del calor es una fórmula de conversión que le permite expresar el calor en julios y viceversa.
¿Cómo calcular el calor con calor latente?
Luego necesitamos calcular el calor necesario para derretir el hielo. El calor latente de fusión del hielo es Lf = 3.34 · 105 J. El calor necesario para producir una fusión completa del bloque de hielo viene dado por: Q2 = Lf · m = 3.34 · 105 · 0.3 J = 105 J.
¿Qué se entiende por conductividad térmica?
La conductividad térmica (λ, unidad de medida: W / (m • K)) describe el transporte de energía, en forma de calor, a través de un cuerpo como resultado de un gradiente de temperatura (Fig. 1). ... En la tabla 2 se proporciona una descripción general de los valores de conductividad térmica para diferentes materiales.
¿Por qué el calor latente de vaporización es mayor que el de fusión?
El calor latente de vaporización del agua es de 2260 kJ/kg (o 540 kcal); es unas siete veces mayor que la de la fusión. Esto significa que se necesita siete veces más energía para vaporizar cierta cantidad de agua que para derretir la misma cantidad de hielo (Figura 3).
¿Cuáles son los 6 cambios de estado?
la transición del estado sólido al líquido → fusión. transición de estado líquido a gaseoso → vaporización. transición de estado gaseoso a líquido → condensación. la transición del estado sólido al gaseoso → sublimación.
¿Cuáles son los cambios en el estado de calor?
Las transiciones de estado que liberan energía son: solidificación (de líquido a sólido), condensación (de vapor a líquido), escarcha (de vapor a sólido). El calor latente varía de una sustancia a otra y del tipo de transición de estado.
¿Cómo se llaman los cambios de estado?
Según el estado de salida y de llegada de la materia, los cambios de estado se identifican con las siguientes denominaciones:- fusión = sólido a líquido.
- solidificación = de líquido a sólido.
- evaporación = de líquido a gas.
- condensación o licuefacción = de gas a líquido.
- sublimación = de sólido a gas.
¿Por qué la temperatura permanece constante durante el cambio de estado?
Aunque continúa calentándose, durante todo el cambio de estado, la temperatura permanece constante: la energía suministrada se utiliza para dilatar y fundir la sustancia. ... · Un líquido puede evaporarse a cualquier temperatura, pero comienza a hervir cuando la presión máxima de vapor iguala la presión externa.
¿Qué magnitud debe variar para que se produzca un cambio de estado?
Al variar la temperatura y la presión, todo tipo de materia, es decir, toda sustancia, puede pasar de un estado de agregación a otro, es decir, sufrir un cambio de estado. Un cambio de estado siempre va acompañado de un intercambio de calor entre la sustancia en cuestión y el entorno circundante.
¿Cómo se llama el cambio de estado de líquido a gaseoso?
Evaporación: la transición del estado líquido al gaseoso; en el ciclo del agua ocurre cuando el agua de los mares, lagos y ríos calentados por el sol se evapora y asciende hacia el cielo.
¿Cómo se calcula el calor específico?
Cómo calcular el calor específico
La fórmula es la siguiente: "Cs = C/m" donde "C" es la capacidad calorífica del cuerpo y "m" es la masa del cuerpo. A su vez, la capacidad calorífica es “C = Q/dt” donde “Q” es la cantidad de calor suministrada a un cuerpo, mientras que “dt” (delta t) es el correspondiente aumento de temperatura.
¿Cuál es el calor específico del hielo?
(37.83 g) (El calor específico del hielo es igual a cg = 2051J/(kg K), el calor específico del agua es igual a aproximadamente = 4186,8 J/(kg K) y el calor latente de fusión del hielo es igual a Qlat_fusione = 3,3 ▪ 105 J / (kg K).
¿Cómo se calcula el calor?
Q = c * m * ∆T
donde: Q es el calor absorbido o cedido por el cuerpo. m es su masa. ∆T es la variación de temperatura.


























