¿Por qué los orbitales se llaman spdf?
Respondo así: Las letras s, p, d, f que indican los diferentes tipos de orbitales son las iniciales de los términos agudo (neto), principal (principal), difuso (diffuse) y fundamental (fundamental) con los que una vez líneas espectrales que caracterizan los espectros atómicos.
¿En qué se diferencian los orbitales?
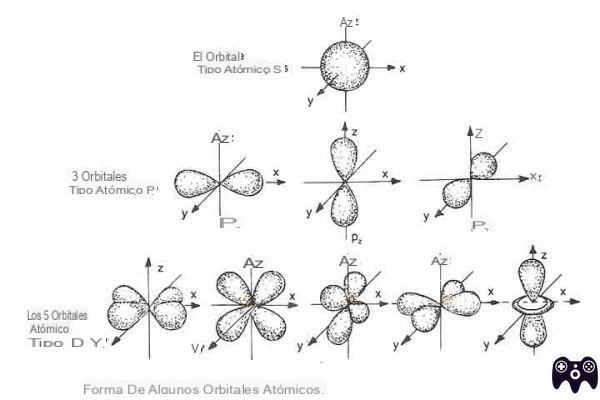
Hay, de hecho, cinco orbitales d para cada energía dada; cuatro de ellos muestran cuatro lóbulos cada uno, uno es ligeramente diferente. En cualquier caso, un electrón que ocupa un orbital d nunca estará en el núcleo.
¿Qué son los orbitales?
Formalmente, un orbital se define como la proyección de la función de onda basada en la posición. ... Por lo tanto, solo pueden tener lugar movimientos de longitud de onda en fase, que definen los orbitales, y, para estar en fase, son múltiplos enteros de un valor base, la constante de Planck.
¿Cuál es la diferencia entre los orbitales s y p?
En cada nivel de energía los orbitales tienen un contenido de energía diferente (s menor que p, p menor que ded menor que f) por lo que podemos distinguir (a partir de n = 2) diferentes subniveles de energía.
¿Cuál es el número máximo de electrones que pueden caber en los orbitales de cuarto nivel?
Por ejemplo, en el 4º nivel (spdf) puedes tener un número máximo de electrones igual a 2 + 6 + 10 + 14 = 32 electrones. Una última cosa: el orden de llenado no es lo que uno esperaría, es decir, 1er nivel, orbital s, 2do nivel, sep, 3er nivel, s, p, d, 4to nivel s, p, d, f .. y así sucesivamente.
ORBITALES ATÓMICOS ¿Qué son? Explicación sencilla.
Encuentra 24 preguntas relacionadas
¿Cuáles son los valores de ninguno de l de los siguientes orbitales?
En el primer nivel de energía n = 1, l puede tomar única y exclusivamente el valor 0. Esto significa que tendremos un solo tipo de orbital, que es el orbital s (indicado como 1s), de forma esférica. Este nivel solo puede albergar dos electrones. En el segundo nivel de energía n=2, l puede tomar los valores 0 y 1.
¿Cuántos orbitales están contenidos en cada subnivel P?
Características del orbital p
Los tres orbitales de tipo p tienen la misma energía y, por lo tanto, se dice que el subnivel de tipo p consta de tres orbitales degenerados.
¿Cuándo hibridan los orbitales?
Además de los metales del grupo 2, el carbono también puede hibridar sp. ... Tras la promoción de un electrón del orbital 2s al orbital 2p, el carbono tiene 4 electrones desapareados. Cuando forma 2 orbitales híbridos sp que se organizan linealmente en ángulos de 180 °, quedan 2 electrones en los orbitales p no hibridados.
¿En qué se diferencian los orbitales 1s y 2s en qué se parecen?
Riepilogo: Orbital 1s vs 2s
Los suborbitales 1 y 2 son los más cercanos al núcleo. La principal diferencia entre los orbitales 1 y 2 es la diferencia en su nivel de energía, que es el orbital 2s es un nivel de energía más alto que el orbital 1s.
¿Cómo funcionan los orbitales?
Cada orbital puede albergar como máximo dos electrones con números de espín opuestos. Los electrones se dispondrán en los orbitales, ocupando primero los de menor energía (es decir, los más cercanos al núcleo) y poco a poco los demás.
¿Cuántos orbitales hay?
Los cinco orbitales de tipo d tienen la misma energía y, por lo tanto, se dice que el subnivel de tipo d consta de cinco orbitales degenerados.
¿Qué y cuántos son los orbitales?
Los orbitales de un átomo se distinguen por cuatro números cuánticos: n, l, m y my, según el principio de Pauli, no es posible que dos electrones tengan el mismo valor para los cuatro números.
¿Para qué sirven los orbitales atómicos?
Las funciones de onda Ψn que se derivan de la resolución de la ecuación de onda y describen el movimiento de los electrones en el átomo se denominan orbitales atómicos. Los orbitales atómicos son, por tanto, funciones matemáticas que describen la naturaleza ondulatoria del electrón en el átomo.
¿Cómo se llaman los orbitales atómicos?
Las áreas adyacentes al núcleo donde es más probable que se encuentren electrones se denominan orbitales atómicos. Se llaman así porque reemplazan la idea de una órbita, ya no se pueden usar. y nos dice que en esa zona hay una alta probabilidad de encontrar el electrón de hidrógeno.
¿Qué significa el número cuántico magnético?
El número cuántico magnético m. Determine el número de orbitales que pertenecen a cada subnivel y su orientación en el espacio. Los orbitales del mismo subnivel son isoenergéticos (degenerados); m puede tomar todos los valores enteros de −la + l, incluido el cero.
¿Cuántos orbitales hay en un átomo?
Al estar formado por un solo orbital (recordemos que un orbital puede contener como máximo dos electrones) el subnivel s puede contener como máximo dos electrones. orbital s. El subnivel p, por otro lado, está formado por tres orbitales de dos lóbulos.
¿Cómo se organizan los electrones en los orbitales?
- El electrón ocupa el primer orbital libre que tiene menos energía. Cuando el electrón tiene que posicionarse dentro de un orbital, elige el que, aún libre, está más cerca del núcleo. - Si hay múltiples orbitales con la misma energía, los electrones tienden a permanecer lo más separados posible.
¿Qué se entiende por nivel o coraza de valencia?
Los electrones de valencia de un átomo son los electrones presentes en su último nivel de energía; son los que participan en la formación de enlaces químicos y son los que determinan las propiedades químicas de un elemento. ... Be, Mg, Ca, Sr, Ba y Ra pertenecen al grupo II y por lo tanto tienen dos electrones de valencia.
¿Cómo se calcula el número de orbitales?
Indica la forma del orbital y depende directamente de “n” ya que puede asumir valores entre 0 y n-1, es decir 0 ≤ l ≤ n-1. l = 0 se encuentra en todos los niveles de n; l = 1 se encuentra en todos los niveles de n desde n = 2 en adelante; del 3er nivel de n en adelante hay l = 2 mientras que l = 3 se encuentra solo del cuarto nivel en adelante.
¿Por qué se produce la hibridación?
La hibridación permite establecer la forma geométrica de una molécula o un ion con el método de Gillespie (1957), que es un refinamiento de la teoría ya desarrollada en 1940 por Nevil Sidgwick y Herbert Marcus Powell.
¿Por qué se forman los orbitales híbridos?
La superposición de orbitales sep a partir de los cuales se obtienen los enlaces σ y los enlaces π describe algunos aspectos del enlace covalente y las moléculas que constan de dos o tres átomos. Por lo tanto, las moléculas que constan de un mayor número de átomos requieren otro modelo para describir la formación de enlaces.
¿Cómo se forman los orbitales híbridos sp3?
De hecho, en la hibridación sp3 un electrón perteneciente al orbital si tres electrones pertenecientes al orbital p forman 4 orbitales híbridos cada uno de los cuales tiene un 25% de carácter y un 75% de carácter p. ... Promueve un electrón del nivel 2s al nivel 2p y por lo tanto presenta 4 electrones desapareados.
¿Cuántos y qué valores puede tener en número cuántico de espines?
número cuántico de espín (componente a lo largo de un eje, convencionalmente el eje z, del espín), s, que puede tomar valores -1/2 o +1/2. En el modelo de Bohr, n determina el radio medio de la órbita del electrón y está relacionado con la cuantización de la energía.
¿Cuál es el número máximo que puede tomar el número cuántico secundario l en la tabla periódica actual?
Posibles valores del número cuántico secundario
Para un valor dado de n, el número cuántico l puede tomar todos los valores entre 0 y n-1.
¿Cuántos orbitales hay para cada número cuántico n?
Primer número cuántico o principal (n)
Para cada valor de n hay diferentes n2orbitales, así: para n = 1, solo hay 1 orbital; para n = 2, hay 4 orbitales; para n = 3, hay 9 orbitales y así sucesivamente.