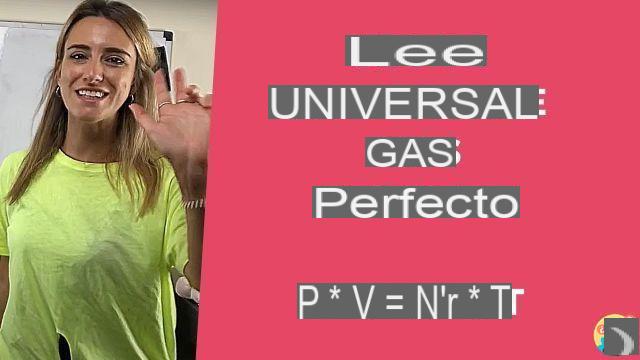
La ley general de los gases describe la relación entre
Resumen sobre la ecuación de estado de los gases 2) La ecuación general de los gases perfectos relaciona la presión P, el volumen V, el número de moles n y la temperatura T con una constante R conocida como constante universal de los gases según la reacción : P V = norte R T.
¿Qué describe la ley general de los gases ideales?
La ley de los gases ideales establece que el producto entre la presión y el volumen de un gas ideal es igual al producto entre el número de moles, la constante de los gases ideales y la temperatura; esta ecuación contiene en sí misma las leyes relativas a las transformaciones isotérmicas, isobáricas e isocóricas de los gases, así como la ley de Avogadro.
¿Para qué sirve la ecuación de estado de los gases?
La ecuación de estado de los gases ideales describe bien el comportamiento de los gases reales para presiones no demasiado altas y para temperaturas no demasiado cercanas a la temperatura de licuefacción del gas. La ecuación de estado de Van der Waals proporciona una mejor descripción del comportamiento de los gases reales.
¿Cuándo es válida la ley de los gases ideales?
La ley de Charles o ley isobárica o primera ley de Gay-Lussac es válida cuando la presión de un gas se mantiene constante; por tanto expresa la relación entre el volumen y la temperatura de un gas mantenido a presión constante.
¿Cuál es la relación entre la constante de los gases R y la constante k de Boltzmann?
Por el principio de Pascal Px = Py = Pz = P. En (3.12) indicamos con ε la energía cinética de una partícula y con k, llamada constante de Boltzmann, la relación entre R y N. En el SI k = 1.38 · 10-23 J/K.
LEY UNIVERSAL DE LOS GASES PERFECTOS
Encuentra 45 preguntas relacionadas
¿Cuánto vale R*?
1er caso: el valor de R se expresa en (L·atm)/(mol·K) es 0,0821.
¿Cómo se obtiene la ley de los gases perfectos?
2) La ecuación general de los gases ideales relaciona la presión P, el volumen V, el número de moles n y la temperatura T con una constante R conocida como constante universal de los gases según la reacción: P V = n R T.
¿Qué ley pones en proporción directa de la presión y la temperatura?
La ley de Gay-Lussac o ley isocórica establece que: a volumen constante, la presión de una determinada cantidad de gas es directamente proporcional a su temperatura absoluta. ¿Podemos decir que la presión de un gas, mantenido a volumen constante, se duplica si su temperatura pasa de 20°C a 40°C?
¿Cómo se calcula la presión del gas?
Cálculo de la presión final de un gas.- P1 · V1 = P2 · V2.
- P1 = presión inicial = 100 mmHg.
- V1 = volumen inicial = 0,5 L = 500 mL. P2 = presión final = X.
- V2 = volumen final = 400 mL.
- P1 · V1 = P2 · V2.
- 100 · 500 = X · 400.
- X = (100 · 500) / 400 = 125 mmHg.
¿Cuál es la fórmula correcta para derivar el volumen de la ecuación de estado del gas perfecto?
Por lo tanto, un gas ideal es un gas que cumple la ley p V = n RT pV = nRT pV = nRT para cualquier valor de presión, volumen y temperatura.
¿Qué es la ecuación de estado?
En termodinámica y química física, una ecuación de estado es una ley constitutiva que describe el estado de la materia bajo un conjunto dado de condiciones físicas. Proporciona una relación matemática entre dos o más variables de estado asociadas con la materia, como la temperatura, la presión, el volumen o la energía interna.
¿Cómo se obtiene la temperatura de un gas?
Esta temperatura se puede obtener igualando a cero el término entre paréntesis del segundo miembro de la ley de Charles, y obtenemos: igual al valor T = 0 K en la escala kelvin, también conocidas como temperaturas absolutas. Ley de Gay-Lussac (v.
¿Cómo se calcula el volumen con la temperatura y la presión?
Para obtener esta cifra, multiplique los moles (n) por la constante de los gases (R) y la temperatura (T), y divida este producto por la presión (P). En el ejemplo visto: V = nRT / P o V = (0,75 x 0,08206 x 296) / 0,95. Según este cálculo, el volumen será de 19,17 litros.
¿Qué son los gases reales?
Un gas real se define como un gas cuyo comportamiento termodinámico difiere del de un gas ideal, es decir, no sigue la ecuación de estado de los gases ideales. ... las moléculas de gas no son puntuales, la energía de interacción no es despreciable.
¿Cómo varía la presión a medida que cambia la temperatura?
La presión atmosférica varía con la temperatura. La presión atmosférica disminuye con el aumento de la temperatura ya que el aire caliente tiende a expandirse, haciéndose menos denso y más ligero. El menor peso de la masa de aire caliente reduce la presión de la columna de aire y la presión atmosférica.
¿Cuándo aumenta la presión de un gas?
La segunda ley de Gay-Lussac establece que, a volumen constante, la presión de cualquier gas aumenta 2 veces la presión inicial por cada grado centígrado de aumento de temperatura. Esto es cierto, por el contrario, si la temperatura desciende en la misma cantidad.
¿Qué sucede cuando se comprime un gas?
Si tomamos un cilindro de acero, ponemos el gas dentro de él, y con un pistón presionamos fuertemente hacia abajo notamos que el pistón desciende fuertemente hacia abajo, el gas se hace más pequeño, es decir, ocupa menos espacio, mejor ocupa menos volumen Se dice que el gas se comprime, es decir, su volumen disminuye.
¿Qué cambio hace que aumente la presión de un gas en un recipiente?
A volumen constante, la presión de un gas es directamente proporcional a su temperatura absoluta. A medida que aumenta la temperatura, las partículas aumentan su energía cinética media pero, mientras el volumen se mantiene constante, aumenta el número de impactos en las paredes del recipiente y por tanto la presión.
¿Cómo calcular el número de moles del gas?
Número de moles de la masa en gramos.- Conociendo la masa en gramos de una sustancia, se debe aplicar la siguiente fórmula para determinar el número de moles:
- M = masa molar * (unidad de medida: g/mol)
¿Cómo se hace la fórmula inversa?
Existe un procedimiento muy sencillo que te permite calcular cualquier fórmula inversa, se basa en que multiplicando o dividiendo ambos miembros de una igualdad por el mismo número se sigue obteniendo una igualdad.
¿A qué es igual R?
La constante R es la constante universal de los gases; se define según el sistema internacional a la temperatura T = 273,15 K = 0 °C a la presión de P = 1 atm = 101325 pa. En estas condiciones 1 kmol de gas ocupa un volumen V = 22,414m3, esto se aplica a todos los gases.
¿Qué es R en física?
Física. R es el símbolo de la resistencia eléctrica. R es el símbolo de röntgen, una unidad para medir rayos X o radiación gamma. R es el símbolo de la constante universal de los gases.
¿Qué significa R en química?
radio (o radio) Elemento químico, radiactivo, símbolo Ra, número atómico 88, peso atómico 226,025.
¿Cómo se encuentra la constante de Boltzmann?
¿Qué es la constante de Boltzmann y cuánto vale? La constante de Boltzmann, denotada por la letra k, es una constante definida por la relación entre la constante R de los gases ideales (constante universal de los gases) y el número de Avogadro (N0).


























