¿Diferencia entre transformaciones reversibles e irreversibles?
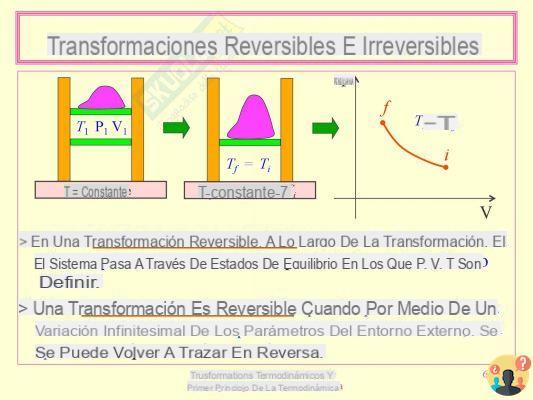
Transformaciones reversibles: la dirección de la transformación se puede invertir, cambiando ligeramente las condiciones externas. Ejemplo: gas comprimido por un pistón. Transformaciones irreversibles: tienen un carácter espontáneo y parecen ocurrir sólo en una dirección. Ejemplo: expansión libre de un gas en el vacío.
¿Qué significa transformaciones reversibles?
Una transformación reversible es una transformación que tiene lugar para que, eventualmente, tanto el sistema como su entorno local puedan volver a sus respectivos estados iniciales, sin que se produzca ningún cambio en el resto del Universo. En caso contrario se dice que la transformación es irreversible.
¿Qué son los procesos termodinámicos irreversibles?
Los procesos IRREVERSIBLES son todos aquellos procesos que no son Reversibles. La irreversibilidad puede ser: INTERNA AL SISTEMA: si se debe por ejemplo al rozamiento, a fuerzas disipativas... que transforman la energía mecánica en calor.
¿Cuál es la diferencia entre reacciones reversibles e irreversibles?
La reacción se representa con una sola flecha que va de los reactivos a los productos. Una reacción química que ocurre solo en una dirección, desde los reactivos hasta los productos, es completa o irreversible. Una vez que ha tenido lugar la reacción, si están presentes tanto los reactivos como los productos, la reacción es incompleta o reversible.
¿Por qué el trabajo reversible es mayor que el trabajo irreversible?
Según la primera ley de la termodinámica, la variación de la energía interna (ΔE) de un sistema es igual al calor menos el trabajo. ... De esta manera he demostrado que en las mismas condiciones el calor intercambiado por un proceso reversible es mayor que el proceso irreversible.
Transformaciones reversibles e irreversibles
Encuentra 28 preguntas relacionadas
¿Qué transformaciones son reversibles?
Transformaciones reversibles: la dirección de la transformación se puede invertir, cambiando ligeramente las condiciones externas. Ejemplo: gas comprimido por un pistón. Transformaciones irreversibles: tienen un carácter espontáneo y parecen ocurrir sólo en una dirección. Ejemplo: expansión libre de un gas en el vacío.
¿Cómo saber si una transformación es reversible o no?
Una transformación es reversible si la diferencia de entropía entre el estado inicial y final de la transformación se debe únicamente a la entropía intercambiada con el entorno.
¿Cómo se representan las reacciones químicas reversibles?
El equilibrio químico se caracteriza por reacciones que no se dan completamente y por tanto, cuando se forma una determinada cantidad de producto, éste coexiste con el reactivo. Tales reacciones llamadas de equilibrio o reversibles se representan con una doble flecha ⇄.
¿Qué son los coeficientes estequiométricos?
Los coeficientes estequiométricos son números enteros (1, 2, 3, etc.) que deben escribirse delante de símbolos químicos de elementos o fórmulas de compuestos para equilibrar una ecuación química.
¿Qué se entiende por velocidad de reacción?
En cinética química, la velocidad de reacción se refiere al cambio en la concentración de los reactivos o productos, o de la masa o de una de las propiedades de la reacción a lo largo del tiempo.
¿Por qué la física trata con transformaciones termodinámicas reversibles?
Propiedades de las transformaciones reversibles
1) La razón por la que se utiliza el término reversible viene dada por el hecho de que una transformación de este tipo se puede realizar a la inversa para volver de B al estado inicial A, sin que el sistema y el entorno sufran cambios.
¿Para qué sirve el ciclo de Rankine?
El ciclo de Rankine creado por William John Macquorn Rankine es un ciclo termodinámico endorreversible compuesto por dos isentrópicas y dos isobaras. Su propósito es convertir el calor en trabajo. Es la base del funcionamiento de la máquina de vapor de cualquier tipo.
¿Qué significa que un coche es reversible?
Cuando todas las transformaciones que componen el ciclo son reversibles, se dice que el sistema constituye una máquina reversible, ya que, para llevar el medio ambiente a sus condiciones iniciales, o para revertir los efectos de la máquina, bastará con revertir la dirección del ciclo.
¿Qué se entiende por transformación termodinámica?
Una transformación termodinámica es un proceso físico en el que un sistema pasa entre dos estados de equilibrio, inicial y final, pasando por una serie de estados intermedios en los que varían una o más magnitudes termodinámicas que lo caracterizan.
¿Qué significa no reversible?
no reversible; dicho en general de todo lo que no puede ser revertido, con respecto al movimiento, la acción ejercida, el funcionamiento, la transmisión de energía, y en el sentido fig. con respecto a la equivalencia, relación lógica, etc.: movimiento, dirección i.; proceso, desarrollo i.; por leyes históricas irreversibles.
¿Qué son las transformaciones cuasiestáticas?
Una transformación cuasiestática es una transformación termodinámica que ocurre extremadamente lentamente, de tal manera que el sistema bajo examen, al pasar de un estado de equilibrio inicial A a un estado de equilibrio final B, pasa por una sucesión de infinitos estados de equilibrio, separados entre sí. ..
¿Cómo derivar los coeficientes estequiométricos?
Fórmula cruda y fórmula específica
Entonces, para calcular cuáles son los coeficientes estequiométricos, tendrás que reescribir la fórmula de la siguiente manera: (a) C "más" (b) H2 ----] (c) CH4, donde a, b y c son los respectivos coeficientes estequiométricos de las moléculas aún se desconocen.
¿Qué significa el número de Avogadro?
, es el número de partículas (átomos, moléculas o iones) contenidas en un mol. Esta constante tiene las dimensiones de la inversa de una cantidad de sustancia (es decir, mol-1). Esta constante es igual a 6,02214076 × 1023.
¿Cómo se encuentra la relación estequiométrica?
En cambio, la relación estequiométrica entre HCl y H2 es de 6:3. Esto significa que por cada 6 moles de HCl que reaccionan, se forman 3 moles de H2 (hidrógeno). La relación estequiométrica 6:3 corresponde a la relación 2:1; por tanto podríamos decir, de forma equivalente, que la relación estequiométrica entre HCl y H2 es 2:1.
¿Cómo se equilibra una reacción?
Para equilibrar una reacción, las fórmulas químicas de los reactivos y los productos deben multiplicarse por los factores numéricos que permiten que aparezca el mismo número de átomos a la derecha ya la izquierda de la ecuación.
¿Cómo se representan las reacciones químicas?
Las reacciones químicas se representan mediante ecuaciones químicas, que incluyen las fórmulas químicas de las sustancias que reaccionan y las de las sustancias producidas, y una ecuación química debe estar balanceada.
¿Cómo saber si una sustancia es pura?
Una sustancia pura tiene una composición definida y constante y se reconoce por sus propiedades físicas y químicas que son definidas y constantes. Algunas propiedades físicas de una sustancia se pueden captar con los sentidos, como el color, el olor, la dureza, el estado físico.
¿Cuál de las siguientes condiciones debe cumplirse para que una transformación sea reversible?
Una transformación reversible debe cumplir las siguientes condiciones: - debe poder realizarse en ambos sentidos; - debe tener lugar en ambas direcciones, pasando por los mismos estados intermedios; ... Toda transformación que no satisface ni siquiera una de las condiciones indicadas se denomina irreversible.
¿Cuándo es reversible una transformación adiabática?
Cuando se produce una transformación sin intercambio de calor (transformación adiabática) tenemos que dQ = 0, es decir que la entropía es constante (la transformación es isentrópica). ... El primero es reversible (por lo tanto isoentrópico): la entropía de los dos estados es la misma.
¿Cuál es el cambio de entropía de un sistema formado por un gas que sufre una expansión adiabática reversible?
El calor intercambiado por las adiabáticas reversibles es cero, por tanto la variación de entropía viene dada únicamente por las isotermas, según: Donde Q es calor y equivale a trabajo (ya que para una isoterma la variación de energía interna es cero).