¿De qué depende la primera energía de ionización?
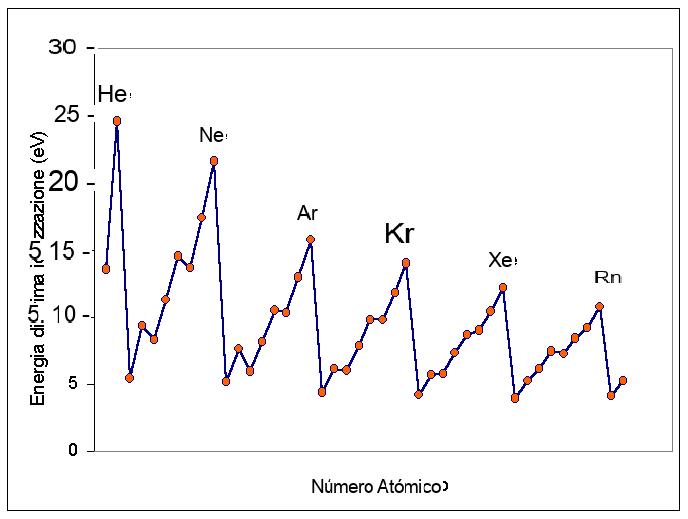
Las energías de ionización dependen del radio atómico. ... Cuantos más electrones protegen la capa exterior del núcleo, menos energía se necesita para expulsar un electrón de ese átomo. Cuanto mayor sea el efecto de protección, menor será la energía de ionización.
¿Cómo se define la primera energía de ionización?
Para alejar electrones de un átomo, es necesario proporcionar energía, llamada energía de ionización, que se mide en kilojulios por mol (kJ/mol), en kilocalorías por mol (kcal/mol) o en electronvoltios (eV). Si el primer electrón externo se aleja del átomo, la energía se denomina primera energía de ionización.
¿Cómo se calcula la primera energía de ionización?
Una vez hecho esto, para calcular la energía de ionización, salvo que el átomo ya haya perdido algunos electrones, tendrás que sacar la raíz cuadrada de Z y multiplicar el resultado por 13,6. El resultado obtenido debe expresarse en electronvoltios.
¿Para qué sirve la primera energía de ionización?
La energía de primera ionización es la energía necesaria para arrancar el electrón más exterior o el que tiene menos energía entre los externos y tiene un valor inferior al de la segunda energía de ionización (energía necesaria para arrancar el segundo electrón) y etc.
¿Por qué disminuye la primera energía de ionización en el grupo?
La disminución descendente a lo largo de un grupo se explica por el hecho de que al pasar de un período al siguiente el electrón más externo ocupa un nivel más alejado del núcleo y por lo tanto es menos retenido.
"Energía de primera ionización" L30 - Química General -
Encuentra 44 preguntas relacionadas
¿Cómo varía la primera energía de ionización en la tabla periódica en grupos y períodos?
La primera energía de ionización es una propiedad periódica. Moviéndose a lo largo de un período de la tabla periódica de izquierda a derecha I1 aumenta, mientras que moviéndose hacia abajo en el mismo grupo disminuye. ... La energía de ionización también en este caso aumenta a medida que nos movemos de izquierda a derecha durante el mismo período.
¿En qué estado físico debe encontrarse el elemento cuyos valores de energía de primera ionización por afinidad electrónica se miden?
La afinidad electrónica (Eea) es la energía liberada o gastada por un átomo o molécula cuando se le añade un electrón a su configuración, cuando se encuentra en estado neutro aislado en forma gaseosa, para formar un ion negativo.
¿Qué significa el número de Avogadro?
, es el número de partículas (átomos, moléculas o iones) contenidas en un mol. Esta constante tiene las dimensiones de la inversa de una cantidad de sustancia (es decir, mol-1). Esta constante es igual a 6,02214076 × 1023.
¿Cuáles son las principales propiedades periódicas de los elementos?
En este artículo profundizaremos en las 4 principales propiedades periódicas de los elementos, que son: radio atómico. potencial de ionización. afinidad electrónica.
¿Cuál es la diferencia entre afinidad electrónica y energía de ionización?
La afinidad electrónica, como la energía de ionización, aumenta durante un período y disminuye durante un grupo; resultados máximos para los elementos en la esquina superior derecha de la tabla periódica.
¿Qué muestra con Compton?
El efecto Compton describe la colisión entre un fotón y un electrón. ... Este efecto puede explicarse de forma sencilla: debemos pensar en los fotones como partículas que, para poder vencer a los electrones presentes en los átomos, se ven obligadas a cederles parte de su energía.
¿Qué se entiende por afinidad electrónica y cuál es la tendencia en TP?
Por afinidad electrónica entendemos la cantidad de energía liberada o absorbida por un electrón cuando se le añade un átomo neutro aislado en la fase gaseosa para permitir la formación de un ion gaseoso con carga igual a menos uno.
¿Qué es la energía de enlace?
En física y química, la energía de enlace es la energía necesaria para mantener unidas las partes de un sistema compuesto.
¿Qué es la segunda energía de ionización?
La primera energía de ionización es la energía requerida para remover un electrón de un átomo neutro y la segunda energía de ionización es la energía requerida para remover un electrón de un átomo con una carga de +1 y así sucesivamente Cada energía de ionización subsiguiente es mayor que la energía anterior.
¿Cuáles son los dos parámetros que influyen en la energía de ionización?
Se utilizan dos parámetros para dar una idea de cuánto tiende un átomo a atraer o alejar electrones: la electronegatividad y la energía de ionización respectivamente.
¿Cómo se llama el ion positivo?
Un gas ionizado se llama plasma. Los iones con carga negativa se conocen como aniones (que son atraídos por los ánodos) y los con carga positiva se denominan cationes (que son atraídos por los cátodos). Los iones se dividen en monoatómicos y poliatómicos.
¿Cuáles son las propiedades periódicas de los átomos?
En química, las propiedades periódicas de los elementos se definen como aquellas cantidades características de cada átomo cuyos valores varían de forma regular, periódica, a lo largo de los períodos y grupos de la tabla periódica. Entre las propiedades periódicas se pueden incluir las siguientes cantidades: Energía de ionización.
¿Qué son los gases nobles?
Se encuentran en el grupo O de la tabla periódica y son He (Helio), Ne (Neón), Ar (Argo), Kr (Kripto), Xe (Xeno), Rn (Rado). La última capa electrónica de gases nobles está siempre completa y esta característica los hace estables e inertes.
¿Qué propiedades atómicas tienen una tendencia periódica?
La afinidad electrónica, que se define como la energía liberada por un átomo cuando adquiere un electrón, también muestra una tendencia periódica. Esto sigue la misma tendencia que la energía de ionización, es decir, disminuye a lo largo del grupo y aumenta a lo largo del período de izquierda a derecha (Fig. 4).
¿Cómo saber el número de átomos de un elemento?
Sustituyendo los datos tendremos: n = m/PM = 0,37 mol. Ahora podemos aplicar el número de Avogadro en la fórmula: nx NA = (0,37 mol) x (6,023 x 10^23 mol^-1) = 2,23 x 10^23 átomos. Este resultado define el número de átomos contenidos dentro de una unidad molecular.
¿Para qué sirve el número de Avogadro?
Por tanto, el número de Avogadro representa el número de entidades contenidas en la unidad mol. Por ejemplo: un mol de iones K+ corresponde a 6,022 · 1023 iones K+; un mol de átomos de Fe corresponde a 6,022 · 1023 átomos de Fe.
¿Cómo se encontró el número de Avogadro?
A partir de la aplicación de la ley de Proust se empezó a calcular la masa de los átomos individuales de los elementos en relación unos con otros. ... El número de Avogadro (generalmente indicado con N) es solo este número; ha sido calculado experimentalmente y es aproximadamente 6,022 · 10 23.
¿Qué elemento tiene mayor afinidad electrónica?
Los elementos del séptimo grupo son los que tienen los valores más altos de afinidad electrónica y por lo tanto la mayor tendencia a adquirir un electrón.
¿Cuál es el elemento con mayor afinidad electrónica?
Los elementos con mayores valores de afinidad electrónica (es decir, los que tienen mayor tendencia a adquirir un electrón para dar iones negativos) son los del lado derecho de la tabla periódica y en particular los halógenos.
¿Cómo se establece la electronegatividad?
Como puede verse, la electronegatividad aumenta en un grupo de abajo hacia arriba y en un período de izquierda a derecha: en consecuencia, los elementos más electronegativos se encuentran en la esquina superior derecha mientras que los menos electronegativos se encuentran en el lado opuesto, en el esquina inferior izquierda.