¿De qué depende la afinidad electrónica?
La afinidad electrónica se puede asociar con el tamaño del átomo: cuanto mayor, menor es el volumen atómico. De hecho, cuanto más pequeño sea un átomo, más cerca del núcleo estará el electrón adquirido, liberando mayores cantidades de energía.
¿Cómo se calcula la afinidad electrónica?
Para predecir algunas propiedades químicas, necesitamos saber cómo varía la energía cuando un electrón se une a un átomo. La afinidad electrónica, Eea, de un elemento es la energía liberada cuando un electrón se une al átomo en fase gaseosa: X (g) + e - (g) → X - (g).
¿Cómo se define la afinidad electrónica?
Por afinidad electrónica entendemos la cantidad de energía liberada o absorbida por un electrón cuando se le añade un átomo neutro aislado en la fase gaseosa para permitir la formación de un ion gaseoso con carga igual a menos uno.
¿Por qué aumenta la afinidad electrónica durante un período?
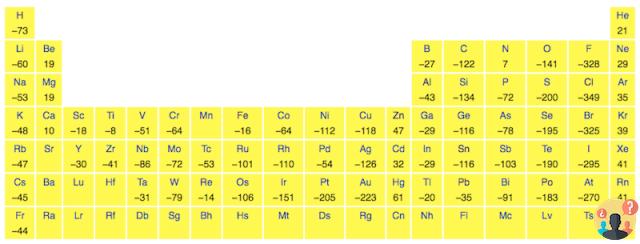
En términos generales, la afinidad electrónica aumenta (es decir, la compra de un electrón se favorece cada vez más energéticamente) moviéndose de izquierda a derecha durante un período, debido al aumento de la carga nuclear efectiva, que se une con más fuerza al electrón adicional.
¿Cuáles son los elementos que muestran una alta afinidad electrónica?
Por ejemplo, el flúor (arriba a la derecha de la tabla periódica) tiene una alta afinidad electrónica porque solo le falta un electrón para obtener la "capa cerrada", por lo tanto obtuvo un electrón y por lo tanto llegó a la capa, liberando energía que estabiliza.
Afinidad electrónica - Lección 7 - ¡Química para las pruebas de ingreso!
Encuentra 39 preguntas relacionadas
¿Por qué la afinidad electrónica es negativa?
La afinidad electrónica mide la tendencia de un átomo neutro en estado gaseoso a captar electrones del exterior. Cuando un átomo neutro adquiere un electrón se convierte en un ion negativo, porque el número de electrones es mayor que el de protones.
¿Cómo aumenta la energía de ionización?
La primera energía de ionización es una propiedad periódica. Moverse a lo largo de un período de la tabla periódica de izquierda a derecha aumenta, mientras que moverse hacia abajo en el mismo grupo disminuye. ... La energía de ionización también en este caso aumenta a medida que nos movemos de izquierda a derecha durante el mismo período.
¿Qué grupo de elementos exhibe los valores más altos de afinidad electrónica?
Los elementos del séptimo grupo son los que tienen los valores más altos de afinidad electrónica y por lo tanto la mayor tendencia a adquirir un electrón.
¿Cómo varía la electronegatividad en la tabla periódica?
Como puede verse, la electronegatividad aumenta en un grupo de abajo hacia arriba y en un período de izquierda a derecha: en consecuencia, los elementos más electronegativos se encuentran en la esquina superior derecha mientras que los menos electronegativos se encuentran en el lado opuesto, en el esquina inferior izquierda.
¿Cuáles son los elementos de transición de la tabla periódica?
Los elementos de transición también llamados metales de transición, metales del bloque d y elementos del bloque d, son cuarenta elementos químicos, todos metálicos, con números atómicos del 21 al 30, del 39 al 48, del 71 al 80 y del 103 al 112: este nombre proviene de su posición en la tabla periódica de los elementos, donde...
¿Cómo se llaman los elementos del primer grupo?
Los metales alcalinos son litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr). Estos elementos químicos forman el grupo 1 del bloque s de la tabla periódica.
¿Qué familia química tiende a formar aniones?
Los no metales que tienen alta electronegatividad atraen electrones para formar aniones. Los metales con baja electronegatividad pierden electrones formando cationes.
¿Qué es el carácter metálico?
Carácter metálico es el nombre que se le da al conjunto de propiedades químicas asociadas a los elementos que son metales. Estas propiedades químicas resultan de la rapidez con la que los metales pierden sus electrones para formar cationes (iones cargados positivamente).
¿Cuándo aumenta la electronegatividad?
La electronegatividad aumenta de izquierda a derecha durante un período, mientras que disminuye a medida que desciende en un grupo. Las variaciones periódicas están relacionadas con el número atómico y, en consecuencia, con el radio atómico.
¿Dónde se encuentran los halógenos en la tabla periódica?
Los halógenos (del griego ἅλς (hàls) + γενος (ghenos), generador de sales) o elementos del grupo 17 de la tabla periódica son: flúor (F), cloro (Cl), bromo (Br), yodo (I) y astate (At). El astato es un elemento radiactivo muy raro.
¿Cuándo se aleja un electrón de un átomo neutro?
Se necesita más energía para alejar un electrón de un ion con carga positiva que de un átomo neutro. ... Los electrones del núcleo tienen un número cuántico principal más bajo y están mucho más cerca del núcleo: son atraídos por él y, para sacarlos, se necesita mucha energía.
¿Cómo varía la electronegatividad de los elementos en un grupo y en un período?
Evolución de la electronegatividad en la tabla periódica
Dado que ambas propiedades (energía de ionización y afinidad electrónica) que determinan el valor de la electronegatividad varían de la misma manera, la electronegatividad aumenta de abajo hacia arriba en grupos y de izquierda a derecha durante un período.
¿Cuándo es un átomo más electronegativo?
La electronegatividad es la capacidad de un átomo para atraer hacia sí los electrones de enlace. Los elementos más electronegativos pertenecen al grupo VII subgrupo A (VIIA) y el flúor (F) es el elemento más electronegativo, su electronegatividad según Pauling es igual a 4.
¿Cómo entender cuál es el átomo más electronegativo?
Los átomos que se encuentran en la parte superior de la tabla periódica tienen una mayor electronegatividad. Por esta razón, los elementos ubicados en la esquina superior derecha tienen mayor electronegatividad que los de la esquina inferior izquierda.
¿Cómo se define la primera energía de ionización cuál es su unidad de medida?
Para alejar electrones de un átomo, es necesario proporcionar energía, llamada energía de ionización, que se mide en kilojulios por mol (kJ/mol), en kilocalorías por mol (kcal/mol) o en electronvoltios (eV). Si el primer electrón externo se aleja del átomo, la energía se denomina primera energía de ionización.
¿Qué átomo tiene el radio atómico más grande entre el potasio y el calcio?¿Explica tu respuesta?
La respuesta es D) potasio. El tamaño atómico disminuye cuando se mueve de izquierda a derecha durante un período; El tamaño atómico aumenta a medida que avanza de arriba hacia abajo en un grupo.
¿Quién tiene la energía de ionización más alta?
A partir de esta tendencia, se dice que el cesio tiene la energía de ionización más baja y que el flúor tiene la energía de ionización más alta (con la excepción del helio y el neón).
¿Cuántos tipos de energía de ionización hay?
La energía de primera ionización es la energía necesaria para arrancar el electrón más exterior o el que tiene menos energía entre los externos y tiene un valor inferior al de la segunda energía de ionización (energía necesaria para arrancar el segundo electrón) y etc.
¿Cómo se calcula la energía de ionización?
Una vez hecho esto, para calcular la energía de ionización, salvo que el átomo ya haya perdido algunos electrones, tendrás que sacar la raíz cuadrada de Z y multiplicar el resultado por 13,6. El resultado obtenido debe expresarse en electronvoltios.
¿Cuáles son los elementos que tienen mayor tendencia a formar iones negativos?
Explica por qué los metales tienden a formar iones positivos mientras que los no metales tienden a formar iones negativos. Los primeros tienen baja energía de ionización, los últimos tienen energías de afinidad electrónica más altas. ¿Qué elemento del cuarto período tiene las propiedades no metálicas más fuertes?