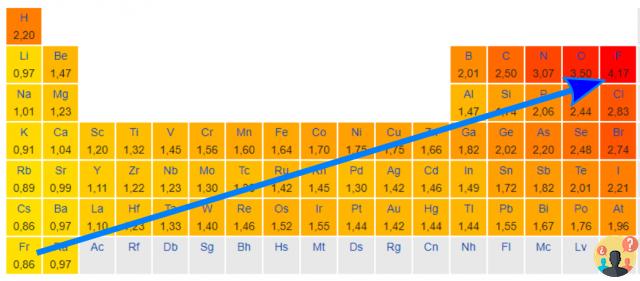
¿Cómo varía la electronegatividad en la tabla periódica?
Como puede verse, la electronegatividad aumenta en un grupo de abajo hacia arriba y en un período de izquierda a derecha: en consecuencia, los elementos más electronegativos se encuentran en la esquina superior derecha mientras que los menos electronegativos se encuentran en el lado opuesto, en el esquina inferior izquierda.
¿Qué se entiende por electronegatividad y cómo varía en la tabla periódica?
La electronegatividad es una propiedad de todos los elementos de la tabla periódica a excepción de los gases nobles del octavo grupo y es la capacidad que tiene un átomo de atraer un electrón hacia sí. El valor 4 se le dio al elemento más electronegativo que es el flúor y valores cada vez más bajos a los demás elementos.
¿Cómo varía la electronegatividad de los elementos en un grupo y en un período?
Evolución de la electronegatividad en la tabla periódica
Dado que ambas propiedades (energía de ionización y afinidad electrónica) que determinan el valor de la electronegatividad varían de la misma manera, la electronegatividad aumenta de abajo hacia arriba en grupos y de izquierda a derecha durante un período.
¿Cómo varía la afinidad electrónica en la tabla periódica?
Tendencia de afinidad electrónica en la tabla periódica.
La afinidad electrónica se puede asociar con el tamaño del átomo: cuanto mayor, menor es el volumen atómico. ... Por lo tanto: la afinidad electrónica aumenta de abajo hacia arriba en un grupo y de izquierda a derecha durante un período.
¿Cuándo es un elemento más electronegativo?
La electronegatividad es la capacidad de un átomo para atraer hacia sí los electrones de enlace. Los elementos más electronegativos pertenecen al grupo VII subgrupo A (VIIA) y el flúor (F) es el elemento más electronegativo, su electronegatividad según Pauling es igual a 4.
ELECTRONEGATIVIDAD - ¿EL JEFE DE LAS PROPIEDADES PERIÓDICAS?
Encuentra 44 preguntas relacionadas
¿Cuándo es un elemento menos electronegativo?
el elemento más electronegativo es el flúor, mientras que los menos electronegativos (o más electropositivos, como se suele decir a veces) son el cesio y el frucio.
¿Cómo varía la afinidad electrónica en general en el período de izquierda a derecha?¿Por qué?
En términos generales, la afinidad electrónica aumenta (es decir, la compra de un electrón se favorece cada vez más energéticamente) moviéndose de izquierda a derecha durante un período, debido al aumento de la carga nuclear efectiva, que se une con más fuerza al electrón adicional.
¿Por qué disminuye la afinidad electrónica a lo largo del grupo?
En cambio, cuando bajas al grupo principal de la tabla periódica, la afinidad disminuye ya que los electrones comienzan a ejercer una fuerza repulsiva que desestabiliza el átomo. Cuanto más mayor que cero sea la cantidad Ae, más estable será la unión formada entre el electrón y el átomo neutro.
¿Cómo entender cuál es el átomo más electronegativo?
Los átomos que se encuentran en la parte superior de la tabla periódica tienen una mayor electronegatividad. Por esta razón, los elementos ubicados en la esquina superior derecha tienen mayor electronegatividad que los de la esquina inferior izquierda.
¿Cómo varía la energía de ionización en la tabla periódica?
La primera energía de ionización es una propiedad periódica. Moviéndose a lo largo de un período de la tabla periódica de izquierda a derecha I1 aumenta, mientras que moviéndose hacia abajo en el mismo grupo disminuye. Hay mucha regularidad en esta tendencia en los bloques principales.
¿Qué determina la electronegatividad?
En química, la electronegatividad es la medida de la cantidad de fuerza con la que un átomo atrae electrones en un enlace. Un átomo con alta electronegatividad atrae electrones con mucha fuerza, mientras que uno con baja electronegatividad los atrae débilmente.
¿Qué significa electronegativo?
- En electrología, generalmente llamado cuerpo o partícula cargado negativamente. En química, un elemento se llama más y. de otro cuando su electronegatividad tiene un valor mayor. ... [de un átomo o elemento que tiende a adquirir uno o más electrones transformándose en un ion negativo] ↔ electropositivo.
¿Cómo varía el tamaño de los átomos en la tabla periódica?
Dentro de la tabla periódica el radio atómico aumenta en un grupo procediendo hacia abajo y en un período disminuye procediendo hacia la derecha. ... en la parte superior derecha de la tabla periódica están los elementos con un radio atómico más pequeño.
¿Cuál es el elemento más electronegativo del NaCl?
Un ejemplo de enlace iónico lo da el cloruro de sodio (NaCl). El cloro tiene una electronegatividad mucho más alta que el sodio (3,0 frente a 0,9).
¿Cuáles son los elementos que muestran una alta afinidad electrónica?
La afinidad electrónica se ve afectada por la regla del octeto. ... Por ejemplo, el flúor (arriba a la derecha de la tabla periódica) tiene una alta afinidad electrónica porque le falta solo un electrón para obtener la "capa cerrada", por lo tanto obtuvo un electrón y por lo tanto llegó a la capa, liberando energía que estabiliza.
¿Cómo varían los radios atómicos de los halógenos a medida que descienden a lo largo del grupo?
Descendiendo en el grupo, a medida que aumenta el número atómico, disminuye el poder oxidante y la electronegatividad, mientras que aumentan los puntos de ebullición y fusión.
¿Por qué la afinidad electrónica es negativa?
La afinidad electrónica mide la tendencia de un átomo neutro en estado gaseoso a captar electrones del exterior. Cuando un átomo neutro adquiere un electrón se convierte en un ion negativo, porque el número de electrones es mayor que el de protones.
¿Cuál es la diferencia entre afinidad electrónica y energía de ionización?
La primera energía de ionización tiene una tendencia periódica; en particular, aumenta durante un período y disminuye a medida que desciende en un grupo. ... La afinidad electrónica es aquella energía que entra en juego cuando el átomo de un elemento en fase gaseosa capta uno o más electrones y se transforma en un ion negativo.
¿Qué grupo de elementos muestra los valores más altos de energía de ionización?
Es debido al efecto de protección que la energía de ionización disminuye de arriba hacia abajo dentro de un grupo. A partir de esta tendencia, se dice que el cesio tiene la energía de ionización más baja y que el flúor tiene la energía de ionización más alta (con la excepción del helio y el neón).
¿Qué indica el número de período sobre la estructura del átomo?
Los períodos en la tabla de elementos tienen una numeración única que va del 1 al 7. El período indica el nivel de energía en el que se encuentran los electrones de valencia. ... A lo largo de estas series de transición hay variaciones modestas en el radio atómico, la electronegatividad y la energía de ionización.
¿Cómo ordenar los electrones?
- El electrón ocupa el primer orbital libre que tiene menos energía. Cuando el electrón tiene que posicionarse dentro de un orbital, elige el que, aún libre, está más cerca del núcleo. - Si hay múltiples orbitales con la misma energía, los electrones tienden a permanecer lo más separados posible.
¿Qué representa la configuración electrónica de un elemento?
La configuración electrónica de un elemento se representa escribiendo los valores de n de los niveles ocupados seguidos de las letras que indican los subniveles y un número, colocado en la parte superior derecha de estas letras, correspondiente al número de electrones presentes en ese subnivel dado.


























