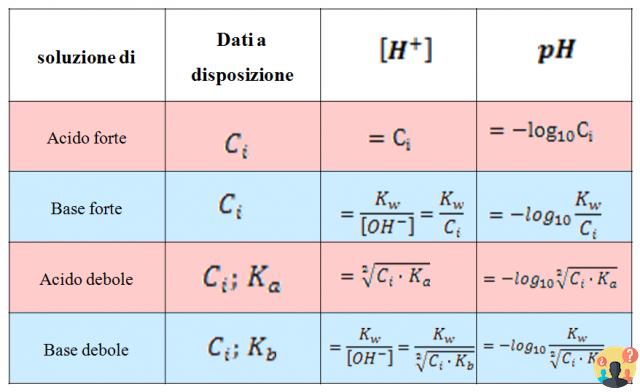
¿Cómo se calcula el pH de soluciones ácidas y básicas?
La ecuación del pH es la siguiente: pH = -log [H3O +].
- A veces, la ecuación del pH se puede representar de la siguiente manera: pH = -log [H +]. Ambas formas representan la misma ecuación.
- Sin embargo, para calcular el pH, no es necesario comprender completamente el significado del logaritmo negativo.
¿Cómo calcular el pH de soluciones ácidas y básicas?
Use una solución ácida más básica
Recuerda que en una solución acuosa la reacción Ácido + Base = Sal + Agua. Si los equivalentes de ácido son iguales a los equivalentes de base, pH = 7, de hecho [H +] = OH -] = H2O] que tiene pH = 7. Si, por el contrario, los equivalentes de H +> de equiv. OH- -> pH = -Log (equiv.
¿Cómo se calcula el pH de una solución ácida?
El pH es un índice de la concentración de los iones H+ en una solución (más precisamente, el logaritmo decimal negativo de la concentración molar de los iones H+ en la solución: pH = - log [H+]).
¿Cómo se calcula el pH de una disolución acuosa?
Calcular el pH de una disolución acuosa que en 100 mL contiene 0,063 g de HNO3. Como el ácido clorhídrico es un ácido completamente disociado, su concentración corresponde a la de los iones [H+], por tanto: [H+] = 10-2 por lo tanto pH = - Log [H+] = -Log 10-2 = 2. Tendremos pH = 2.
¿Cómo calcular el pH de una base fuerte?
Para calcular el pH de una solución de un ácido fuerte o el pH de una solución de una base fuerte, en el caso de ácidos y bases monopróticos, basta con conocer la concentración de Ca del ácido o la concentración de Cb de la base expresada en términos de molaridad.
Lección 5 - Cálculo del pH de una solución de un ácido fuerte
Encuentra 29 preguntas relacionadas
¿Cómo saber si es un ácido o una base?
cuando la diferencia entre los átomos de hidrógeno y oxígeno es MAYOR o igual a 2, el ácido en cuestión es FUERTE; si es MENOS de 2, el ácido es DÉBIL. En H2SO3 la diferencia entre H y O es 1 por lo que el ácido es débil; en H2SO4 la diferencia es 2, por lo que el ácido es fuerte.
¿Cuáles son los cimientos débiles?
Ejemplos de bases débiles: NH3 (amoníaco), aminas (compuestos orgánicos de fórmula general RNH2). En solución acuosa, por lo tanto, solo hay iones OH- y moléculas de HA. Ejemplos de ácidos fuertes son: HCl (ácido clorhídrico), HBr (ácido bromhídrico), HI (yoduro de hidrógeno), HNO3 (ácido nítrico), HClO4 (ácido perclórico).
¿Cómo se calcula el pH de una solución?
El PH se define como una escala de medida utilizada para expresar el carácter ácido o básico de las soluciones:- un pH por debajo de 7 (pH <7) indica una solución ácida.
- un pH superior a 7 (pH > 7) indica una solución básica.
¿Cómo se calcula el pH químico en línea?
- Calculemos el pH: pH = - log [H +] = pH = - log 10-9 = 9.
- Calculemos el pOH: pH + pOH = 14. Por lo tanto: pOH = 14 - pH = 14 - 9 = 5.
- determinar [OH-].
¿Cuál es el pH de una solución acuosa de NaCl 02 m?
Por lo tanto, las soluciones acuosas de NaCl tienen un pH neutro (pH = 7).
¿Qué es el pH químico en línea?
El concepto de pH (léase "pi-acca") nació para expresar de forma sencilla la concentración de los iones H3O + presentes en solución, sin recurrir a números exponenciales. La letra p colocada delante de la H indica que se debe tomar el logaritmo negativo de la concentración de los iones H+.
¿Cómo explicar el pH de una manera sencilla?
El pH no es más que la unidad de medida de la acidez y basicidad de una solución acuosa. De hecho, el pH está correlacionado con la concentración de iones H+ en la solución. El pH se mide en una escala de valores que va del 0 al 14.
¿Cómo se calcula el pH y Poh?
Luego introdujo el símbolo “p” y definió el pH como - log [H +] por lo tanto, por ejemplo, una solución que contiene [H +] = 1.0 ∙ 10-4 M tiene un valor de pH de 4.0. Asimismo, pOH se define como el logaritmo, cambiado de signo, que tiene como argumento la concentración del ion [OH–]: pOH = - log [OH–].
¿Cómo bajar el pH naturalmente?
Para bajar paulatinamente el pH del suelo, es recomendable ir administrando estiércol y materia orgánica a lo largo del tiempo. Para acidificar el suelo es posible utilizar otros líquidos naturales como jugo de naranja, limón o tomate. El mantillo también puede ayudar a corregir el pH del suelo.
¿Qué significa que una sustancia es básica?
En química, según el significado más común, el término básico identifica sustancias generalmente cáusticas y corrosivas, capaces de atacar los tejidos orgánicos y teñir de azul el papel tornasol. Ejemplos de sustancias básicas son el amoníaco, la sosa cáustica y los tipos más comunes de jabón.
¿Cómo se mide el pH?
Por lo tanto: pH = −log [H +]. Esta relación analítica deriva de la técnica potenciométrica (introducida por SPL Sörensen en 1909) con la que se realizaron las primeras mediciones precisas de la concentración de iones de hidrógeno, para las cuales el valor medido del potencial es función del logaritmo de las concentraciones.
¿Cómo distinguir bases fuertes y bases débiles?
La fuerza de los ácidos y las bases se define por el grado de disociación, α, por lo que un electrolito (un ácido o una base): es fuerte cuando en solución acuosa puede considerarse completamente disociado en iones; es débil cuando su disociación es parcial, porque se establece un equilibrio dinámico entre la parte...
¿Cómo entender cuál es la base más fuerte?
- Cuanto más fuerte es una base, menor es el valor de la constante de.
- Ka equilibrio termodinámico de su ácido conjugado, mayor.
- es el número pKa de su ácido conjugado.
¿Cómo sabes qué ácido es más fuerte?
acuosa, el ácido más potente es H3O +. Clorhídrico. Constante de disociación).
Cosa dice la teoria di Arrhenius?
Arrhenius fue el primero en proponer una teoría ácido-base basada en el comportamiento de estas sustancias en el agua. Un ácido es una sustancia que, cuando se disuelve en agua, provoca un aumento en la concentración de iones H+. Una base es una sustancia que, cuando se disuelve en agua, provoca un aumento en la concentración de iones OH-.
¿Cómo puedo saber si es una sal?
Rebajas- En química, una sal es un compuesto químico eléctricamente neutro que consiste en un conjunto de varios iones (aniones y cationes), generalmente dispuestos dentro de una red cristalina, unidos por un enlace iónico de diversos grados de ionicidad.
- Las sales tienen diferentes grados de solubilidad en los diferentes disolventes.
¿Cuál es la base conjugada de HSO4?
¿Cuál es la base conjugada de HSO4-?
Aunque tiene carga negativa, nunca aceptará H+ para formar H2SO4 (ácido sulfúrico). Esto se debe a que el ácido sulfúrico es un ácido fuerte y se disocia completamente en agua. Por lo tanto, el ion sulfato (SO2−4) es la base conjugada de HSO−4.
¿Cuál es el valor de pH de una solución que contiene 0 g de HCl?
¿Cuál es el pH de una solución de HCl 0,05 M? Por lo tanto, es un ácido fuerte. Por lo tanto, la solución tiene un pH = 1,30 y, por lo tanto, es una solución ácida.