¿Cómo pueden las moléculas apolares atraerse entre sí?
)
¿Cómo pueden las moléculas apolares atraerse entre sí? enlaces de hidrógeno.
¿Cómo se atraen las moléculas no polares?
Una molécula polar puede inducir un momento dipolar inducido sobre una molécula apolar distante r, dando lugar a una interacción intermolecular atractiva: donde μ es el momento dipolar de la molécula polar y α' es el volumen de polarizabilidad de la molécula no polar.
¿Qué fuerzas de atracción mantienen unidas a las moléculas no polares?
Las interacciones entre moléculas no polares
Entre los dipolos, mientras existan, se crea una atracción electrostática que los mantiene unidos, llamada fuerza de dispersión de London. ... Luego, al aumentar la masa molecular, aumentan las fuerzas de London y Van der Waals.
¿Qué hace que una molécula sea polar?
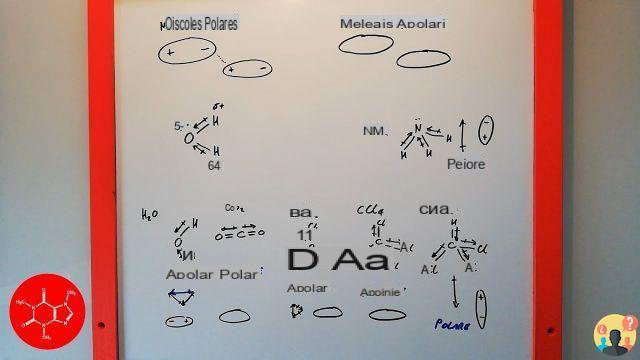
En química, la polaridad es una propiedad de las moléculas por la que una molécula (llamada polar) tiene una carga positiva parcial en un lado de la molécula y una carga negativa parcial en el lado opuesto. Las moléculas que no presentan el fenómeno de la polaridad se denominan apolares o no polares.
¿Qué moléculas tienen una distribución asimétrica de cargas?
En general, las moléculas que, debido a una distribución asimétrica de la carga eléctrica, tienen dos polaridades distintas en su interior se denominan moléculas polares. Las sustancias formadas por moléculas de este tipo se denominan sustancias polares. Las moléculas polares también se llaman simplemente dipolos.
Moléculas polares y apolares (polaridad y apolaridad de una molécula) - lección de química
Encuentra 29 preguntas relacionadas
¿Cómo saber si una molécula es polar o no?
La polaridad de las moléculas se da cuando el centro de gravedad de las cargas positivas no coincide con el centro de gravedad de las cargas negativas. Si no hay enlaces polares en una molécula, es decir, la diferencia de electronegatividad entre los dos átomos, la molécula es no polar.
¿Por qué la molécula de agua es asimétrica?
Cuando el átomo central de una molécula tiene uno o más pares de electrones no enlazados, la molécula es asimétrica y, dado que los momentos dipolares individuales no se anulan entre sí, también es polar en su conjunto. Este es, por ejemplo, el caso del agua, H2O y el amoníaco, NH3 (ver tabla 5.2).
¿Qué significa que una molécula es polar?
Una molécula polar es una molécula caracterizada por un momento dipolar resultante distinto de cero. Para evaluar la presencia de un momento dipolar resultante que no sea cero, es necesario sumar vectorialmente todos los momentos dipolares de los enlaces covalentes polares simples y verificar que el momento resultante sea distinto de cero.
¿Qué son las moléculas polares?
Ejemplos de moléculas polares son: H2O, NH3, CH3Cl. Ejemplos de moléculas apolares son: las formadas por dos elementos iguales como O2, Cl2 y H. Moléculas simétricas como CH4, CCl4, BeCl2.
¿Qué significa moléculas polares?
apolar [Comp. de a-privat. y polar "libre de polaridad"] Molécula a.: molécula que no tiene su propio momento eléctrico dipolar. dipolo Sistema formado por dos entidades idénticas pero de distinta polaridad.
¿Cuáles son las fuerzas que mantienen unidas a las moléculas?
Las fuerzas que mantienen unidas a las moléculas (fuerzas intermoleculares) son de naturaleza eléctrica y son básicamente de dos tipos: fuerzas de atracción dipolo-dipolo (entre moléculas polares) y fuerzas de dispersión de London (entre moléculas apolares).
¿Qué fuerzas se establecen entre moléculas apolares?
Los enlaces electrostáticos entre dipolos permanentes se denominan fuerzas dipolo-dipolo. Las fuerzas de London son interacciones electrostáticas debidas a la atracción entre moléculas apolares que forman dipolos temporales debido al desequilibrio en la distribución de electrones.
¿Qué son los enlaces no covalentes?
El enlace covalente apolar es el que se crea entre átomos de diferentes elementos pero con electronegatividad muy similar y por lo tanto diferencia casi nula. Un ejemplo es el metano, CH4, que tiene carbono con electronegatividad igual a 2,4 e hidrógeno igual a 2,1, ¡entonces la diferencia será de 0,3!
¿Cuál es el enlace más polar?
De hecho, el hidrógeno tiene electronegatividad 1, nitrógeno 3 y fósforo 2,1; el enlace más polar es por lo tanto el enlace P → N.
¿Cómo saber si un disolvente es polar?
La polaridad de un solvente se puede medir por medio de la constante dieléctrica o el momento dipolar eléctrico. Los disolventes polares tienen una constante dieléctrica y un momento dipolar altos, mientras que los disolventes no polares tienen una constante dieléctrica y un momento dipolar bajos.
¿Por qué el agua es una molécula polar?
Cuanto más electronegativo es un átomo, mayor es su fuerza de atracción hacia los electrones del enlace. ... Los dos enlaces covalentes polares significan que el agua es una molécula polar, por lo tanto, está equipada con un polo ligeramente negativo y dos polos ligeramente positivos.
¿Por qué la molécula de HCl es polar?
❖ Por ejemplo, el HCl es polar porque la diferencia de electronegatividad entre estos dos átomos es 0,9 y, por lo tanto, el enlace es covalente polar, el Cl es más electronegativo que el H, por lo que el Cl es δ– y el H es δ+. ❖ Si por el contrario la molécula está formada por varios átomos, debemos considerar el átomo central.
¿Cuándo es polar un enlace?
Un enlace covalente polar se establece cuando los orbitales atómicos de dos átomos se superponen con una diferencia de electronegatividad menor o igual a 1,9 y mayor a 0,4.
¿Cuál es la polaridad del agua?
Cada enlace covalente polar simple de la molécula de agua se puede representar mediante un vector cuya dirección se dirige hacia el polo negativo del dipolo (y por lo tanto hacia el átomo de oxígeno). ... La molécula de agua es polar porque los enlaces covalentes son polares y están dispuestos de tal manera que no se anulan entre sí.
¿Cuál es la diferencia entre un enlace polar y una molécula polar?
Un enlace polar es un enlace covalente entre dos átomos, los electrones de enlace están distribuidos de manera desigual. En el primer caso la diferencia de electronegatividad es cero por lo que el enlace es covalente puro y la molécula es apolar. ...
¿Cómo se unen las moléculas de agua entre sí?
Las moléculas de agua se unen entre sí a través de un enlace llamado "hidrógeno", este tipo de enlace, que se forma entre un átomo de hidrógeno de una molécula y un átomo electronegativo (como el oxígeno) de otra molécula, es responsable tanto de las características como de la química. - propiedades físicas ...
¿Por qué la molécula bh3 es apolar?
El boro ha donado todos sus 3 electrones, la molécula no tiene polos, es apolar.
¿Cuáles son las características de la molécula de agua?
Todos sabemos que la molécula de agua está formada por un átomo de oxígeno y dos átomos de hidrógeno, nada fuera de lo común aparte de la forma de V, con el átomo de oxígeno más grande en la parte superior y los dos átomos de hidrógeno pequeños en los extremos opuestos, separados entre sí. otra desde un ángulo de 104,45°.
¿Cómo determinar la estructura de una molécula?
Para determinar la geometría molecular es necesario calcular el valor del número estérico NS sumando el número de átomos (X) enlazados al átomo central (A) y el número de pares de electrones libres presentes en el átomo central (E). En base a este valor es posible predecir la geometría de la molécula.
¿Cuándo son las moléculas solubles en agua?
Generalmente, cuando solo está presente un grupo polar, la molécula sigue siendo soluble en agua si el radical hidrofóbico de la molécula no excede los 4 átomos de carbono de cadena lineal o los 5 átomos de cadena ramificada.