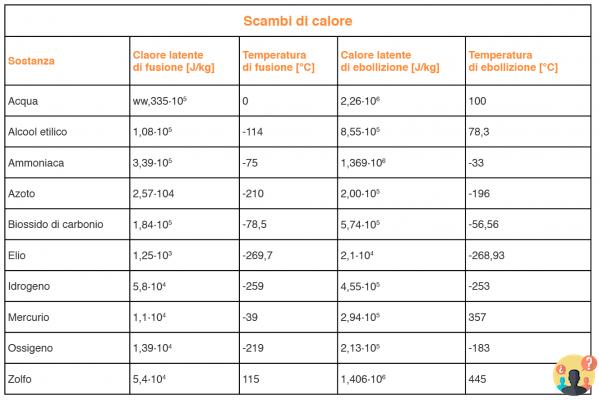
¿Calor latente de fusión del hielo?
Se sabe que el calor latente de fusión del hielo es igual a 333,5 J/g. El calor latente de fusión del hielo indica la cantidad de calor necesaria para derretir un gramo de hielo a una temperatura de 0 °C.
¿Cómo se calcula el calor latente de fusión del hielo?
Luego necesitamos calcular el calor necesario para derretir el hielo. El calor latente de fusión del hielo es Lf = 3.34 · 105 J. El calor necesario para producir una fusión completa del bloque de hielo viene dado por: Q2 = Lf · m = 3.34 · 105 · 0.3 J = 105 J.
¿Qué significa calor latente de fusión?
Por ejemplo, el "calor latente de fusión" es la energía máxima correspondiente al paso de un sistema (compuesto por una o más sustancias químicas) del estado sólido al líquido. ...
¿Cómo calcular el calor latente de solidificación?
El calor latente de solidificación es numéricamente igual al calor latente de fusión. Se requieren 1 0 J para derretir 334 kg de hielo a 000°C; si 1 kg de agua a 0°C se solidifica y se convierte en hielo, proporciona 334 000 J de calor.
¿Cuál es la ley que expresa el calor latente de vaporización?
Definición de calor latente de fusión y vaporización.
Considerando la transición del estado líquido al estado de vapor, podemos definir el calor latente de vaporización (λv) como la cantidad de energía necesaria para evaporar completamente 1 gramo de sustancia a temperatura de ebullición.
Calorimetría 3: calor latente de fusión del hielo
Encuentra 37 preguntas relacionadas
¿Cómo varía el calor latente con la presión?
El calor latente también depende del cambio de fase que se considere y, para una misma sustancia y a la misma temperatura y presión, asume valores numéricos opuestos para cada cambio de estado y para su inverso (dependiendo de si la sustancia absorbe o libera calor).
¿Qué expresa el ∆ T?
Indica la cantidad de calor que debe suministrarse a una sustancia para elevar su temperatura en un kelvin (K). Decir que una sustancia tiene una gran capacidad calorífica significa que puede absorber mucho calor elevando ligeramente su temperatura.
¿Cómo se calcula el calor específico?
Cómo calcular el calor específico
La fórmula es la siguiente: "Cs = C/m" donde "C" es la capacidad calorífica del cuerpo y "m" es la masa del cuerpo. A su vez, la capacidad calorífica es “C = Q/dt” donde “Q” es la cantidad de calor suministrada a un cuerpo, mientras que “dt” (delta t) es el correspondiente aumento de temperatura.
¿Cuál es el calor específico del hielo?
(37.83 g) (El calor específico del hielo es igual a cg = 2051J/(kg K), el calor específico del agua es igual a aproximadamente = 4186,8 J/(kg K) y el calor latente de fusión del hielo es igual a Qlat_fusione = 3,3 ▪ 105 J / (kg K).
¿Cómo se calcula el calor?
Q = c * metro * ∆T
donde: Q es el calor absorbido o cedido por el cuerpo. m es su masa. ∆T es la variación de temperatura.
¿Por qué el calor latente de vaporización es mayor que el de fusión?
El calor latente de vaporización del agua es de 2260 kJ/kg (o 540 kcal); es unas siete veces mayor que la de la fusión. Esto significa que se necesita siete veces más energía para vaporizar cierta cantidad de agua que para derretir la misma cantidad de hielo (Figura 3).
¿Qué forma de energía modifica el calor latente?
El calor latente es la energía absorbida o liberada por una especie durante un cambio de estado sin cambio de temperatura. El calor latente puede entenderse como energía térmica que se suministra o se extrae para cambiar el estado de una sustancia sin cambiar su temperatura.
¿Cómo calcular el calor de vaporización?
La relación entre el calor q y la entalpía viene dada por la siguiente ecuación:- q = ΔHvap (mol) ...
- 1) Se lleva a ebullición una masa igual a 49.5 g de agua. ...
- 2) Calcular la entalpía de vaporización del agua en J/g y en cal/g.
¿Cuál es el calor necesario para derretir 500 g de hielo?
En última instancia, se requiere un calor igual a 6,09 · 106 J para poder derretir completamente el hielo y calentar el agua que se deriva del hielo derretido hasta una temperatura de 60 °C.
¿Cuánto calor se necesita para derretir 3 kg de hielo?
Añadimos la potencia de diez al calor latente de fusión ya que este se medía en KJ/kg o 103 J/kg. En última instancia, se necesita un calor de 307,4 ∙ 103 J para poder derretir completamente el cubo de hielo.
¿Cuánto calor se necesita para subir?
En efecto, la masa de agua a calentar es igual a 1 gramo, el calor específico del agua expresado en J/(g · °C) es de 4,18 y la temperatura del agua debe aumentarse en 20 °C.
¿Para qué se utiliza el calor específico?
El calor específico es una propiedad característica de las sustancias, y expresa la cantidad de calor necesaria para elevar la temperatura de una masa de 1 kg de la sustancia en 1 °C.
¿Cómo se calcula el calor específico molar?
Determinar la capacidad calorífica molar.
En el ejemplo anterior, el calor específico es igual a 4.184 J/(g*K). Lo que debes hacer ahora es simplemente multiplicar este coeficiente por la masa molar y obtendrás el calor específico molar: 4,184 x 18 = 75,312 J / (mol * K).
Cual es el calor específico del metal?
c2 = 4186 J/(kg∙K)
¿Cuáles son los 6 cambios de estado?
la transición del estado sólido al líquido → fusión. transición de estado líquido a gaseoso → vaporización. transición de estado gaseoso a líquido → condensación. la transición del estado sólido al gaseoso → sublimación.
¿Cuál es el papel del calor durante los cambios de estado?
Cuando se calienta un sólido, la agitación de sus moléculas aumenta y los enlaces que las mantienen unidas se separan. ... Cuando se enfría un aeriforme, la agitación de las moléculas disminuye hasta que se pueden volver a establecer enlaces entre ellas: el aeriforme se vuelve líquido.
¿Cómo se define la temperatura a la que coexisten las fases sólida y líquida?
Durante todo el período de tiempo en el que coexisten las fases sólida y líquida, la temperatura permanece congelada a 327 °C.
¿Cómo calcular el calor sustraído?
La cantidad de calor que se extrae del motor es igual a la cantidad de calor que adquiere el agua a medida que se calienta. donde c es el calor específico de la sustancia que está adquiriendo la cantidad de calor Q; en nuestro caso c representa el calor específico del agua.
¿Cuándo la entropía tiene un valor negativo?
El cambio de entropía puede ser positivo o negativo. En particular, es positivo cuando el sistema recibe calor y negativo cuando lo libera.